Научная статья
Original article
УДК 615.33
doi: 10.55186/2413046X_2022_7_10_599
МИРОВАЯ ФАРМАЦЕВТИЧЕСКАЯ ПРОМЫШЛЕННОСТЬ ДЛЯ ЖИВОТНЫХ.
THE WORLD ANIMAL PHARMACEUTICAL INDUSTRIES
Жиганова Л.П. кандидат биологических наук, старший научный сотрудник Института США и Канады Российской академии наук (ИСКРАН), Российская Федерация, 121069, Москва, Хлебный пер., д.2/3 (Larissa-Zhiganova@yandex.ru)
Zhiganova Larissa Petrovna, PhD in Biology, senior resercher, Institute of USA and Canada Studies, Russian Academy of Sciences (ISKRAN) 2/3 Khlebny pereulok, Moscow, Russian Federation 121069, e-mail: Larissa-Zhiganova@yandex.ru
Аннотация. В статье описываются основные фармацевтические препараты антибактериального действия для животных в условиях множественной устойчивости к ним. А также производится сравнительный анализ медицинских препаратов для человека и ветеринарных препаратов для животных. Дается описание структуры и объема фармацевтической индустрии. В статье исследуются основные направления НИОКР в области фарминдустрии.
Abstract. The article describes the main pharmaceutical drugs – antibiotics for animals in the age of antibiotic resistance. This article analyzes сomparatively the medicine drugs for human and pharmaceuticals for animals. In the article is given the structure and the volume animal pharmaceutical industries. Also presents the general trends of scientific investigations in veterinary pharmacology.
Ключевые слова: животноводство, антибиотики, фармацевтические препараты, лекарства, ветеринарные фармпрепараты, сельское хозяйство
Key words: Livestock, antibiotics, pharmaceuticals, drugs, veterinary pharmaceuticals, agriculture
Фармацевтическая отрасль производства препаратов для ветеринарного применения исследует, разрабатывает и продает лекарства, биодобавки и пестициды для домашних и мясомолочных животных. Производители вносят существенный вклад в повышение продуктивности сельского хозяйства и проводят исследования также интенсивно, как это происходит в области биотехнологий, семенного фонда и производстве пестицидов [1].
Размер отрасли и структура
Мировые продажи фармацевтической продукции для животных показывают стабильный рост: с 18,5 млрд долларов в 2005 году до 24,2 млрд долларов на начало 2016 г. [2]. Темпы роста в тот период составляли, в среднем, 2,7% в год. В отрасли доминируют девять крупных компаний, которые в 2015 г. реализовали продукцию на сумму около 21 млрд долларов (87% от общего объема продаж ветеринарной продукции). В период с 2014 по 2015 гг. слияния в отрасли возросли, а доля девяти ведущих компаний в общем объеме продаж выросла с 80% до 87%. Таким образом, отрасль становилась более концентрированной, что могло сказаться на темпах инновационных исследований.
Отрасль имеет общемировую распространенность, филиалы крупных компаний работают во многих странах, однако 60% продаж осуществляется в государствах Северной Америки и Западной Европы [6]1). Непосредственно на США приходится треть мировых продаж фармацевтических препаратов для животных [7]. Штаб-квартиры ведущих фармкомпаний по производству продукции ветеринарного применения находятся в США и ЕС, и многие продукты изначально рассчитаны на эти рынки.
1) 78% продаж пришлось на США и ЕС (США с учетом стран Латинской Америки и Северной Америки; ЕС с учетом стран Западной и Восточной Европы).
Помимо крупных игроков, в отрасли работают и более мелкие компании. И если первые реализуют препараты-дженерики и занимаются НИОКР, то вторые – могут просто производить дженерики (или оригинальные препараты с истекшим сроком действия патента) или работать с рецептурой.
Взаимодействие между фармацевтическими производствами препаратов для человека и для животных
В промышленном производстве препаратов для животных и для человека много общего. Методики НИОКР схожи и нацелены на разработку аналогичных препаратов для лечения соответствующих (но не идентичных) заболеваний. И там, и там необходимо пройти дорогостоящую и длительную процедуру получения разрешения контролирующих органов, прежде чем продукция поступит на рынок, а защита производителя реализована через систему патентов. Лекарства продаются как без рецепта, так и по назначению лицензированного специалиста в письменном виде (для человека – это рецепт от врача; для животных – рецепт от ветеринара или ветеринарные директивы VFD).
Несмотря на распространенность по всему миру, размеры отрасли несопоставимы с фармацевтическим производством препаратов для человека. В этом секторе продажи составили почти 1 триллион долларов [8] в 2014 г., что в 42 раза больше по сравнению с продукцией для животных (23,9 млрд долларов) [2].
В 2015 г. шесть из семи ведущих компаний ветеринарной продукции являлись дочерними подразделениями производителей медикаментов для человека, а лидер продаж – компания Zoetis – только недавно отделилась от материнской Pfizer. Одним из источников новых компонентов для ветеринарии традиционно являются так называемые «отходы» от разработок препаратов для человека в материнской компании [4]. Формулы с доказанной эффективностью у человека, как правило, и идут в этот сектор, поскольку рынок намного больше, а ветеринарным компаниям зачастую остаются компоненты с нежелательными для человека свойствами (напр., не соответствуют требованиям по токсичности). Если оба типа производства находятся в одной материнской компании, это упрощает доступ к результатам исследований. Однако бывает и так, что за разработку медицинских и ветеринарных препаратов отвечают разные подразделения даже в одной компании, и они не обмениваются информацией друг с другом.
Виды продукции
Продукция для ветеринарного применения реализуется не только в животноводстве, на которое пришлось 64% от общего объема мировых продаж. Оставшиеся 36% – это препараты для домашних животных. Примечательно, что в США имеет место обратная тенденция: в 2016 г. 60% продаж составила продукция для домашних животных, и 40% – для мясомолочных в 2018 г. [7]. По данным мировой статистики, в секторе мясного животноводства наибольшая доля продаж зафиксирована для крупного рогатого скота (25,1%), на втором месте свиноводство (17,6%) и птицеводство (11%) [6].
Всю продукцию можно условно разделить на три категории: лекарственные препараты, биопрепараты и лечебные кормовые добавки. Все они могут применяться у домашних и мясомолочных животных.
- Лекарственные препараты включают противоинфекционные средства, такие как антибиотики, противопаразитарные, а также экзогенные гормоны и ряд других. Управление по контролю качества пищевых продуктов и лекарственных средств США (FDA) обозначает этот класс как «продукт, предназначенный для использования в диагностике, лечении, облегчении течения или профилактике заболеваний человека или животных».
- Биопрепараты – это, в основном, вакцины2). FDA определяет их как «любые вирусы, сыворотки, токсины или аналогичные продукты природного или синтетического происхождения, предназначенные для использования при лечении животных и действующие в первую очередь путем прямой стимуляции, дополнения, усиления или изменения работы иммунной системы или иммунного ответа».
- Лечебные кормовые добавки включают аминокислоты, антибиотики, витамины, антиоксиданты, питательные ферменты и другие препараты, добавляемые в корм. Данные вещества позиционируют как лекарства, с соответствующим контролем за их оборотом. Немедикаментозные кормовые добавки не обозначаются как лекарства, включают витамины и минералы и, в основном, не реализуются фармацевтическими предприятиями ветеринарного профиля.
2) Биопрепараты также включают «бифидобактерии, аллергены, антитела, диагностикумы, антитоксины, иммуностимуляторы, антигенные или иммунизирующие компоненты микроорганизмов, нацеленные на профилактику, диагностику и лечение заболеваний у животных».
Таким образом, антибиотики входят в подгруппу двух категорий: лекарственные препараты и лечебные кормовые добавки. Лекарственные препараты составили наибольшую долю продаж ветеринарной продукции для животноводства (58%). Биопрепараты составили около трети объема продаж (30%), а на лечебные кормовые добавки пришлось 12% [2].
Компания «Animal Pharm» (сбор данных и консалтинг) сообщила, что в 2017 г. участники рынка собрали выручку в 5 млрд долларов от реализации противомикробных препаратов для животных [10]. Это составляет примерно 19% от общемирового годового объема продаж (он составил 26 млрд долларов в 2017 г.).
В таблице 1 приведены данные ведущих производителей ветеринарных препаратов о том, какова доля антибиотиков в общем объеме доходов от продаж.
Совпадения классификаций фармацевтической продукции медицинского и ветеринарного назначения
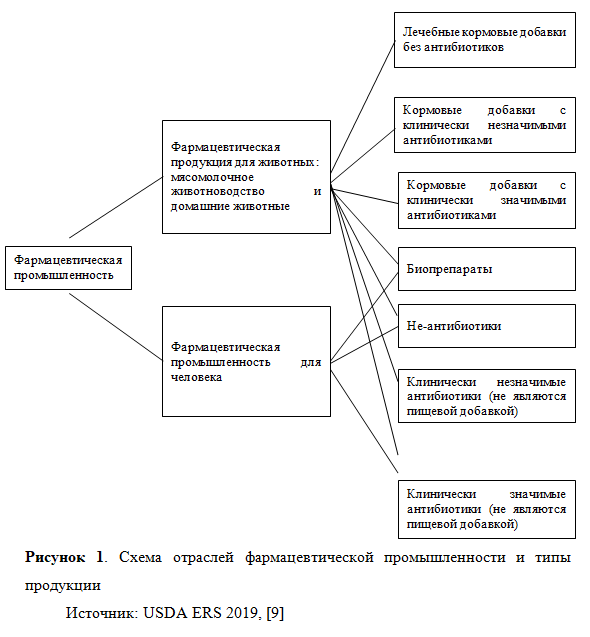
Фармацевтические компании разрабатывают аналогичные типы продуктов для человека и животных – это факт, который актуален не только для НИОКР, но и для разработки антибиотиков (рис. 1). В обоих секторах производят как лекарственные, так и биопрепараты, однако у человека неприменимы лечебные кормовые добавки, при том, что деление на антибиотики и не-антибиотики является универсальным (лечебные кормовые добавки также могут быть с антибиотиками или без таковых). Антибиотики для животных подразделяют на «клинически значимые» (т.е. подходящие для лечения заболеваний человека) и «клинически незначимые» в текущий период времени.
Совпадения в классификации позволяют фармпроизводителям для животных использовать результаты НИОКР, проводимых для разработки продукции для человека. Поскольку рынок медицинских препаратов огромен, участники могут позволить себе дорогостоящие инновации и разработки. Однако, эта зависимость делает производство ветеринарных препаратов уязвимым при смене приоритетов в области здоровья человека. Если направления исследований в области охраны здоровья животных и человека совпадают, то открытия в медицине можно с легкостью использовать и для животных, в противном же случае, производители ветеринарной продукции остаются за рамками прогресса, т.к. самостоятельно провести необходимые исследования им крайне затруднительно.
Что же касается антибиотиков, то за последние десятилетия все меньше новых разработок, что вызывает растущее беспокойство. Сложности в создании новых антибиотиков для человека, соответственно, распространяются и на ветеринарную отрасль.
Разработка и утверждение продукта
Процесс разработки продукта долгий и сложный. Компания должна принять взвешенное решение, как вложить средства, выделенные на исследования. До поступления в продажу новый продукт проходит несколько этапов (разработка, производство и регистрация), и в процессе многие потенциальные продукты-кандидаты отсеиваются. Создание нового лекарства для животных занимает от 7 до 10 лет, а разработка новых ветеринарных вакцин от 3 до 5 лет.
Контролем качества продукции для здоровья животных в США занимаются Управление по контролю качества пищевых продуктов и лекарственных средств (FDA), Министерство сельского хозяйства США (USDA) и Агентство по охране окружающей среды (EPA). Служба инспекции по охране здоровья животных и растений центра ветеринарных биопрепаратов Министерства сельского хозяйства США (APHIS CVB) отвечает за регулирование ветеринарных биопрепаратов; EPA контролирует продукцию, которая относится к пестицидам, а Центр ветеринарной медицины FDA (FDA CVM) – традиционные лекарственные препараты и пищевые добавки. Традиционные лекарственные препараты обычно синтезируют химическим путем, их структурная формула известна, в то время как биопрепараты (например, вакцины) относятся к биологическим продуктам, которые обычно представляют собой комплексные составы со сложными характеристиками. Противомикробные препараты подпадают под действие правил FDA.
Чтобы получить разрешение на лекарственный препарат от FDA CVM спонсор продукта должен предоставить информацию о химическом составе и рецептуре препарата, инструкцию по применению и доказательную базу по трем пунктам [11]. Во-первых, препарат должен обладать эффективным действием в соответствии с тем, как это описано в инструкции по применению. Во-вторых, спонсор должен иметь возможности постоянного производства продукта в соответствии с надлежащей производственной практикой. И, наконец, препарат должен быть безопасен для животных, окружающей среды и человека при применении в соответствии с инструкцией [12]. Для одобрения новых антибиотиков требуются последующие клинические испытания. Обычно регистрация лекарственного препарата для мясомолочной отрасли в США занимает более 7 лет. Учитывая, что этап разработки проходит в течение 2-3 лет, внедрение продукта обычно занимает 10 лет и более от момента возникновения идеи, до выхода на рынок [6].
В общих чертах процесс утверждения ветеринарных биопрепаратов сравним с таковым для лекарственных препаратов. Заявители должны показать, что их продукт безопасен (для животных, человека или потребителя), эффективен и соответствует производственным критериям. APHIS CVB выдает лицензии на ветеринарные вакцины, средства диагностики биологического происхождения и другие продукты.
Лечебные препараты также могут входить в состав кормов для животных в качестве «кормовой добавки». Если продукт является лекарственным или биологическим, он регулируется как таковой, независимо от того, входит ли он в состав корма. Вместе с тем, FDA контролирует и немедицинские кормовые добавки (например, витамины, эфирные масла, растительные добавки), но по другим критериям. Добавки целевого назначения, одобренные FDA, или добавки, которые «общепризнаны как безопасные» (GRAS), не требуют получения дополнительного разрешения на использование. В остальных случаях на новую добавку или область применения необходимо одобрение FDA. Процесс обычно предполагает доказательства безопасности предлагаемого использования добавки, но не требует подтверждения эффективности.
Поскольку значительная часть продаж ветеринарной продукции осуществляется за пределами США, получение разрешения контролирующих органов является международным видом деятельности. Для традиционных лекарств двумя наиболее важными регуляторами являются FDA в США и Европейское агентство по лекарственным средствам в ЕС [9]. Большинство стран едва ли готовы разрабатывать национальные правила с нуля, и их регулирующие органы будут ссылаться на FDA, Европейское агентство по лекарственным средствам и другие международные организации по охране здоровья животных, такие как Всемирная организация здравоохранения животных или Продовольственный кодекс (Codex Alimentarius) [13]. Ряд требований к исследованиям также согласованы в ЕС, США и Японии через Международную конференцию по гармонизации технических требований для регистрации ветеринарных средств (VICH). Тем не менее, одобрение должно быть получено от каждой регулирующей структуры, часто для одобрения заявки требуется доказательная база с учетом специфики конкретной страны (особенно, если климатические условия сильно различаются) [11].
Патенты и дженерики
Компании стремятся защитить свою продукцию с помощью патента. Патентное право, как правило, зависит от страны, и патентная защита должна быть получена в каждой стране, где зарегистрирован продукт.
В то время, как одобрение регулирующих органов дает право производителю продавать свою продукт, патент отнимает право у других участников рынка реализовывать таковой в течение определенного периода времени. Патенты выдаются по принципу очередности, что стимулирует производителей подавать заявки в кратчайшие сроки, как только они получили перспективный препарат. Вместе с тем, патент обычно предоставляет исключительное право на продажи на 20 лет, большая часть из которых будет потрачена на получение разрешения регулирующих органов для выпуска продукта на рынок. Помимо патентования регулирующие органы могут предоставлять короткие периоды исключительного права на продажи рассматриваемых препаратов. Например, фармацевтический продукт для животных, ранее не одобренный (напр., для других видов или показаний) получает исключительное право на 5 лет от FDA. Это означает, что в течение этого периода сразу после одобрения препарата, FDA не будет принимать заявки на дженерики данного продукта [14] [9].
Как только продукт теряет патентную защиту, конкуренты могут разрабатывать альтернативные варианты-дженерики. Обычно это приводит к значительному снижению продаж оригинального препарата. Падение продаж ветеринарных препаратов в таких случаях менее выражено, хотя и зависит от колебаний рынка. На дженерики приходится всего 10% продаваемых препаратов для здоровья животных, и ни одна крупная, с хорошей капитализацией компания не делает ставку на производство дженериков для животных. Любой потенциальный дженерик-кандидат также должен получить одобрение регулирующих органов. В США одобрение ветеринарных дженериков началось с 1988 г., а первые препараты вышли на рынок в 1992 г. [15] [9] Для одобрения дженерика требуется доказать, что препарат точно соответствует ранее одобренному оригиналу, при этом проводить заново клинические испытания безопасности и эффективности не требуется. Для дженериков биопрепаратов подобного универсального процесса нет.
Расходы, доходы и прибыль в течение жизненного цикла препарата
После многолетних расходов успешный продукт выходит на рынок и начинает приносить доходы с продаж. Однако, первое время продажи просто компенсируют затраты на НИОКР. И может пройти более десяти лет, прежде чем эти затраты полностью окупятся.
Жизненный цикл лекарственного препарата состоит из трех стадий. На стадии 1 производитель проводит НИОКР и подает заявку в регулирующие органы. В течение этого периода компания ежегодно несет высокие расходы и не имеет доходов, потому что препарат еще не одобрен для продажи. В итоге производитель вложил большие средства, а прибыль от препарата в минусе. Как только лекарство одобрено, начинается стадия 2. В большинстве случаев компания получает временную монополию (благодаря патентной защите, исключительным правам на продажи от FDA и временному промежутку, необходимому конкурентам для выхода на рынок). Доходы в этот период высокие, а расходы сокращаются до уровня затрат на производство лекарства. Годовая прибыль выражается как разница между доходами и расходами, и на стадии 2 она в плюсе, но может не покрыть расходы на НИОКР стадии 1, поскольку на это требуется время.
В какой-то момент на рынок может выйти конкурент-дженерик, и оригинальный препарат вступит в стадию 3. Не обязательно, что в течение этого периода расходы на производство лекарства поменяются, однако производителю, возможно, придется конкурировать с дженериком и снижать цену. Годовая прибыль на стадии 3 резко падает.
Таким образом, несмотря на высокие доходы по сравнению с производственными расходами на стадии 2, общая рентабельность препарата за все три периода, учитывая затраты на НИОКР, была значительно ниже.
***
- Всю фармацевтическую продукцию для животных можно условно разделить на три категории: лекарственные препараты, биопрепараты и лечебные кормовые добавки. Все они могут применяться у домашних и мясомолочных животных. Таким образом, антибиотики входят в подгруппу двух категорий: лекарственные препараты и лечебные кормовые добавки.
- Штаб-квартиры ведущих фармкомпаний по производству продукции ветеринарного применения находятся в США и ЕС, и многие продукты изначально рассчитаны на эти рынки.
- Совпадения в классификации позволяют фармпроизводителям для животных использовать результаты НИОКР, проводимых для разработки продукции для человека. Поскольку рынок медицинских препаратов огромен, участники могут позволить себе дорогостоящие инновации и разработки.
- Создание нового лекарства для животных занимает от 7 до 10 лет, а разработка новых ветеринарных вакцин от 3 до 5 лет.
- В общих чертах процесс утверждения ветеринарных биопрепаратов сравним с таковым для лекарственных препаратов для человека.
Список источников
- Fuglie K.O., P.W. Heisey, J.L. King, C.E. Pray, K. Day-Rubenstein, D. Schimmelpfennig, S.L. Wang, and R. Karmarkar-Deshmukh. 2011. Research Investments and Market Structure in the Food Processing, Agricultural Input, and Biofuel Industries Worldwide, ERR-130. USDA, Economic Research Service.
- 2018. “About: Our Sector.” Available online (accessed Sept. 20, 2018).
- Shapiro, C. 2012. “Competition and Innovation: Did Arrow Hit The Bull’s Eye?” in The Rate & Direction of Economic Activity Revisited. J. Lerner and S. Stern (eds). Chicago: University of Chicago Press. Shryock, T.R. 2004.
- Shryock, T.R., and A. Richwine. 2010. “The Interface Between Veterinary and Human Antibiotics Use,” Annals of the New York Academy of Sciences 1213(1):92-105.
- Piddock, L.J.V. 2012. “The Crisis of No New Antibiotics – What Is the Way Forward?” The Lancet: Infectious Diseases 12(3):249-253.
- International Federation for Animal Health (IFAH). 2006, 2008, 2009, 2012. IFAH Annual Report. Brussels, Belgium.
- Pham, N., and M. Donovan. 2018. The Economic and Social Contributions of the Animal Health Industry, ndp Analytics. Washington, DC.
- IMS Health Market Prognosis. May 2015. IMS Health Market Prognosis.
- Sneeringer S., Bowman M., and Clancy M. 2019. The U.S. and EU Animal Pharmaceutical Industries in the Age of Antibiotic Resistance. Economic Research Repor, Number 264.
- Watt, H. 2018. “How Much Does Big Pharma Make From Animal Antibiotics?” The Guardian, June 19.
- Meyer, S. 2014. “Animal Health Market in the Bric Countries and Comparison of Its Regulatory Requirements for Veterinary Medicinal Products with EU Legislation.” Master’s Thesis.
- S. Food and Drug Administration (FDA). 1989, 1990, 1991, 1992, 1993, 1994, 1995, 1996, 1997, 1998, 1999, 2000, 2001, 2002, 2003, 2004, 2005, 2006, 2007, 2008, 2009, 2010, 2011, 2012, 2013, 2014, 2015, 2016. Approved Animal Products (Green Book).
- 2014, 2015, 2017. Annual Report. Florham Park, NJ.
- S. FDA. 2018b. Frequently Asked Question on Patents and Exclusivity.
- S. FDA. 2018c. Generic Animal Drug and Patent Term Restoration Act (GADPTRA). Center for Veterinary Medicine.
Для цитирования: Жиганова Л.П. Мировая фармацевтическая промышленность для животных. // Московский экономический журнал. 2022. № 10. URL: https://qje.su/selskohozyajstvennye-nauki/moskovskij-ekonomicheskij-zhurnal-10-2022-35/
© Жиганова Л.П., 2022. Московский экономический журнал, 2022, № 10.