Научная статья
Original article
УДК 632.93; 577.2
doi: 10.55186/2413046X_2023_8_11_584
ПРИМЕНЕНИЕ ГЕННОЙ ИНЖЕНЕРИИ ДЛЯ РЕШЕНИЯ ПРОБЛЕМЫ ИЗМЕНЕНИЯ КЛИМАТА В ЖИВОТНОВОДСТВЕ
APPLICATION OF GENE EDITING FOR CLIMATE CHANGE IN LIVESTOCK FARMING
Жиганова Л. П. кандидат биологических наук, старший научный сотрудник Института США и Канады Российской академии наук (ИСКРАН), Российская Федерация, 121069, Москва, Хлебный пер., д.2/3 (Larissa-Zhiganova@ yandex.ru)
Zhiganova Larissa Petrovna, PhD in Biology, senior researcher, Institute of USA and Canada Studies, Russian Academy of Sciences (ISKRAN) 2/3 Khlebny pereulok, Moscow, Russian Federation 121069, e-mail: Larissa-Zhiganova@yandex.ru
Аннотация. В статье анализируется влияние изменения климата на сельскохозяйственные системы, продовольственную безопасность и питание человека. В этой связи учеными предложены технологии по редактированию генов в животноводстве для адаптации к изменению климата. Описаны примеры новых направлений по редактированию генов, направленных на изменение признаков сельскохозяйственных животных в ответ на климатические угрозы. Также представлено обсуждение технических ограничений и рисков применения методов ген-редактирования животных.
Abstract. In article the influence of climate change on agricultural systems, food security, and human nutrition is analysed. In this regard the scientists offered new technologies in crop and livestock gene editing beneficial for climate change adaptation. Many examples of emerging gene editing applications and research initiatives that are aimed at the improvement of livestock in response to climate change, and discuss technical limitations and risks therein.
Ключевые слова: ген-редактирование, изменение климата, продовольственная система, продовольственная безопасность, биоразнообразие, генетика домашнего скота
Keywords: gene editing, climate change, food system, food security, biodiversity, genetics of livestock
ВВЕДЕНИЕ
Влияние изменения климата на сельское хозяйство, биоразнообразие, на жизнедеятельность общества в целом трудно переоценить. Считается, что основной причиной изменения климата является антропогенный выброс парниковых газов в атмосферу.
«Изменение климата наступило. Это ужасно. И это только начало. Эпоха глобального потепления закончилась; наступила эпоха глобального кипения» (Антонио Гутерриш, Генеральный секретарь ООН, 27 июля 2023).
Опубликованный в марте 2023 года заключительный доклад Межправительственной группы экспертов по изменению климата (МГЭИК) дал оценку текущего климатического кризиса и предложил пути решения этой проблемы в прямом смысле планетарного масштаба [23]. Одним из наиболее перспективных — является применение генной инженерии в сельском хозяйстве вообще, и в животноводстве в частности. Считается, что такие технологии смогут помочь организмам адаптироваться к изменению климата, или же смягчить неблагоприятные последствия новых условий окружающей среды. Редактирование генома было впервые разработано в 1990-х годах. До появления распространенных современных платформ ген-редактирования, его использование было ограничено низкой эффективностью. Сегодня метод модификации генома с помощью инженерных нуклеаз — цинковых пальцевых нуклеаз (ZFNs), эффекторных нуклеаз, подобных активаторам транскрипции (TALENs), и инженерных мегануклеаз – было выбрано Nature Methods (Нейче Мэтодс) в качестве метода года в 2011 г. [2]. Система CRISPR/Cas была выбрана Science (Сайнс) как прорыв года в 2015 г. [3]. И если вначале использовались четыре семейства ферментов, то через два года было доступно уже девять редакторов генома [4]. С 2018 г. начали активно использоваться сконструированные нуклеазы, или «молекулярные ножницы». Эти ферменты создают сайт-специфические двуцепочечные разрывы (DSB) в нужных местах генома. Индуцированные двуцепочечные разрывы восстанавливаются посредством негомологичного соединения концов (NHEJ) или гомологичной рекомбинации (HR), что приводит к целенаправленным мутациям, то есть – «редактированию». Таким образом, осуществляется точное редактирование генов [5].
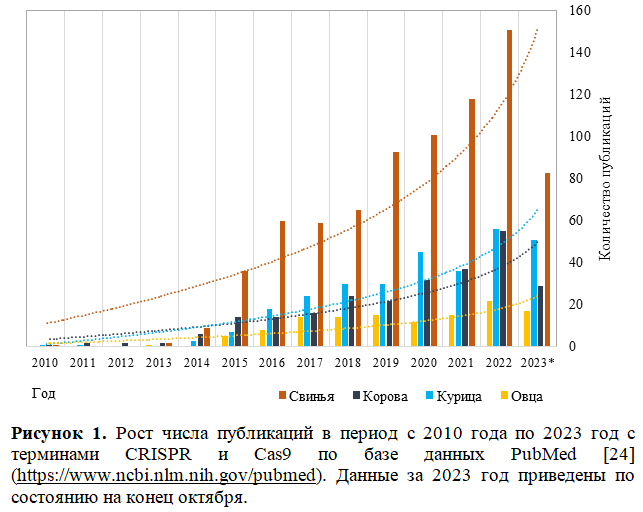
В результате манипуляций с геномом происходит модификация ДНК в определенных участках, нокаут или нокдаун одного или нескольких генов. Также, гены одного организма могут быть перенесены в определенные участки генома другого организма, чтобы сформировать новый признак. Благодаря эффекторным нуклеазам (TALEN, ZFN и CRISPR/Cas) точность и эффективность внесения изменений значительно выросли. Наиболее применяемым является редактор CRISPR/Cas, о чем свидетельствует растущее количество исследований с каждым годом (рисунок 1).
Применение методов редактирования генов многократно повышает потенциал развития сельскохозяйственного животноводства в области адаптации к наступающим негативным последствиям глобального изменения климата.
ПРИМЕНЕНИЕ ГЕННОЙ ИНЖЕНЕРИИ В ЖИВОТНОВОДСТВЕ
Изменение климата уже сегодня негативно сказывается на животноводстве, и эта тенденция продолжает усиливаться. Повышение температуры и изменение количества осадков напрямую влияют непосредственно на скот, а также на кормовые культуры, и течение заболеваний. Повышение температуры окажет, пожалуй, наиболее сильное воздействие: тепловой стресс снижает потребление корма и привес, снижает репродуктивную активность, имеет общее негативное влияния на состояние здоровья и увеличивает смертность многих видов домашнего скота [6].
Также ожидается рост заболеваемости в связи с появлением новых переносчиков, мутаций вирусов и бактерий в результате новых условий окружающей среды [1]. Перекрестное взаимодействие множества климатических и антропогенных переменных не дает возможности точно предсказать, как именно изменение климата повлияет на патогены животных. Предположительно, регионы с умеренным климатом могут столкнуться в будущем с ростом трансмиссивных болезней, характерных для тропических зон. Это приведет к появлению новых популяций животных-хозяев, не имеющих приобретенного иммунитета, и потенциально создаст новые пути и схемы передачи инфекций [1].
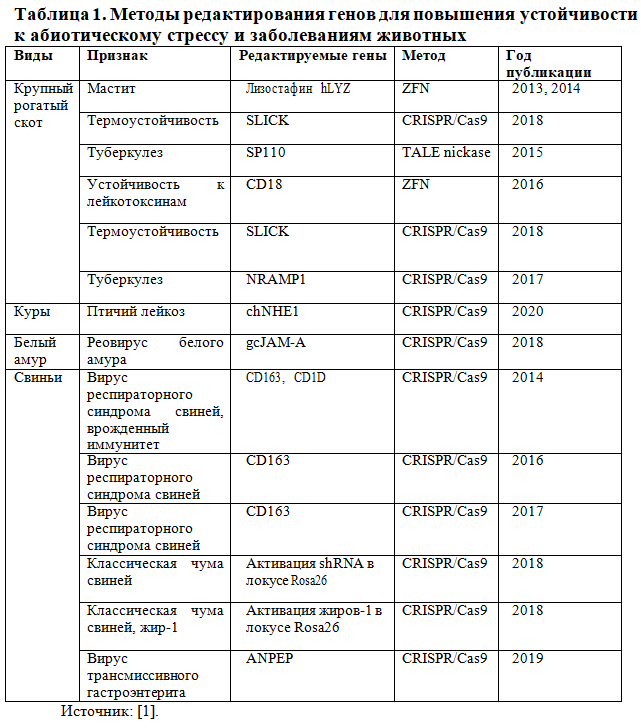
Редактирование генов предлагает решения для управления как текущими, так и постоянно возникающими новыми глобальными угрозами продуктивности сельского хозяйства (абиотический стресс, заболевания) (Таблица 1).
Повышение термоустойчивости у крупного рогатого скота
У животных примером редактирование генов для смягчения абиотического стресса, вызванного изменением климата, является повышение термоустойчивости у крупного рогатого скота. Так, в частности, компания Acceligen (Акцелижен), дочерняя структура Recombinetics Inc. (Рекомбинетикс Инкорпорейшн), при поддержке Фонда пищевых и сельскохозяйственных исследований (FFAR) и компании Semex (Симикс) применила генную технологию по улучшению термоустойчивости крупного рогатого скота. Исследование сосредоточилось на воспроизведении фенотипа SLICK (СЛИК), первоначально описанного у коров Сенепольской породы. Животные более термоустойчивы, о чем свидетельствуют более низкие температуры влагалища, более низкие ректальные температуры, более низкая частота дыхания и повышенное потоотделение, что дает увеличение надоев молока в летние месяцы [7]. Используя методы редактирования генов, Acceligen (Акцелижен) стремится воспроизвести генотип SLICK (СЛИК), и таким образом гарантировать хорошую адаптацию селекционных пород к условиям высоких температур.
Устойчивость к вирусам у кур
У кур вирусный лейкоз птиц подгруппы J представляет собой заболевание, которое поражает мясные породы и кур-несушек, и характеризуется высокой смертностью. Методом CRISPR/Cas9 была создана гомологичная рекомбинация с делецией во внеклеточной части гена chNHE1, который кодирует вирусный рецептор, позволяющий инфицировать клетки. Делеция была проведена в примордиальных зародышевых клетках кур, что в результате трансплантации и последующего разведения привело к появлению цыплят, устойчивых к заражению вирусом [9].
Устойчивость к туберкулезу и маститу у крупного рогатого скота
Повышению устойчивости крупного рогатого скота к туберкулезу посвящено два исследования. В первом исследователи сосредоточились на мышином гене SP110, который контролирует инфицирование Mycobacterium tuberculosis и индуцирует апоптоз (генетически запрограммированную физиологическую гибель клетки) в инфицированных клетках. Авторы использовали TALEN для вставки гена в определенное место генома крупного рогатого скота посредством гомологичной рекомбинации; нокаутирование этого гена повысило устойчивость к туберкулезу [10]. Второе исследование с использованием CRISPR/Cas9 позволило вывести ген врожденного иммунитета NRAMP1 (естественный макрофагальный белок-1, связанный с резистентностью) посредством гомологичной рекомбинации. Полученные линии животных также обладали повышенной устойчивостью к туберкулезу [11].
Аналогичным образом редактирование генов использовалось для предотвращения мастита, одного из тяжелых заболеваний молочных коров. В двух исследованиях гомологичная рекомбинация методом ZFN позволила встроить два гена, обеспечивающих устойчивость к инфицированию грамположительной бактерией Staphylococcus aureus (возбудитель мастита). Ген, кодирующий лизостафин у Staphylococcus simulans, и ген человеческого лизоцима (hLYZ) были встроены в интрон бета-казеинового локуса коровы. Лизостафин представляет собой металлоэндопептидазу. Он может действовать как бактериоцин (противомикробное средство) против золотистого стафилококка. Казеин — это белок молока, и поэтому гены, вставленные в бета-казеиновый локус, будут имитировать экспрессию бета-казеина, а экзогенные белки будут присутствовать в молоке отредактированных коров [12]. В обоих этих исследованиях были получены молочные коровы с молоком, которое могло предотвратить заражение лактирующих коров Staphylococcus aureus.
Устойчивость к вирусным болезням у свиней
Методами генной инженерии были получены особи свиней с устойчивостью к вирусным заболеваниям за счет выключения двух генов, CD163 и CD1D. Первый необходим для заражения вирусом репродуктивно-респираторного синдрома свиней (вирус РРСС), а второй участвует в формировании врожденного иммунитета. Исследователи проверили отредактированных свиней (нокаут Cd163) на устойчивость к вирусу РРСС и обнаружили, что при заражении у них не проявлялось никаких симптомов. Для сравнения, у потомков дикого типа развились серьезные осложнения, потребовавшие их эвтаназии. Аналогичные результаты были получены и в более позднем исследовании, авторы которого также использовали CRISPR/Cas9 для выключения гена CD163 и получения свиней, полностью устойчивых к вирусу РРСС [1]. В дальнейших экспериментах на свиньях были получены животные, устойчивые к вирусу классической лихорадки свиней (выключение генов CSFV, КЧС в локусе Rosa26), при том, что у дикого типа летальность составила 100% [14]. Также у свиней в локус Rosa26 был внедрен ген fat-1 свободноживущей почвенной нематоды Caenorhabditis elegans [15]. Этот ген участвует как в устойчивости к болезням, так и в повышении питательных качеств мяса. Таким образом, исследование стало еще одним примером того, как можно с помощью генной инженерии одновременно улучшить пищевую ценность свинины и повысить устойчивость животных к болезням. Также, уже опубликованы результаты выключения гена ANPEP (аминопептидазы N) методом CRISPR/Cas9, что обеспечивает устойчивость к коронавирусным инфекциям [13].
Устойчивость к вирусам у водных видов
Редактирования генов для борьбы с болезнями у водных видов пока еще ограничено. Первое использование системы CRISPR для повышения устойчивости к болезням отмечено в 2018 году. Исследователям удалось получить в клеточных линиях белого амура нокаут гена gcJAM-A (кодирует молекулу соединительной адгезии-A белого амура), участвующего в реовирусной инфекции вида (GCRV). Было показано, что при заражении GCRV отредактированные клетки подавляют репликацию вируса [1].
ПОВЫШЕНИЕ ПРОДУКТИВНОСТИ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ
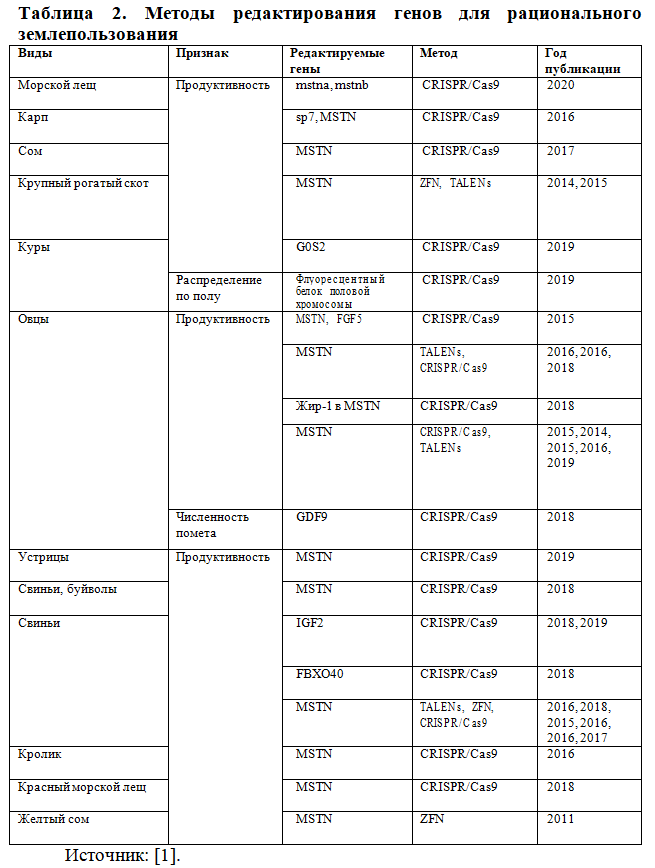
Глобальное изменение климата будет приводить к значительному снижению продуктивности животноводства. В некоторых регионах она может повыситься, но в основном новые условия окружающей среды потребуют от животных ускоренной адаптации, которая не всегда возможна при усиленном давлении внешних факторов. Все это создаст серьезную угрозу продовольственной безопасности. Смягчить негативные последствия для животноводства призвана генная инженерия как потенциальный инструмент для достижения этой цели (Таблица 2) [1].
Повышение продуктивности за счет выключения гена MSTN
При редактировании генов животных усилия были сосредоточены на таргетировании гена MSTN у таких видов, как свиньи, крупный рогатый скот, овцы, козы, кролики и некоторые водные животные, включая карпа, сома и красного морского леща [1]. Ген MSTN (также известный как GDF8) кодирует миостатин, фактор дифференцировки роста, который ингибирует рост мышц. В естественных популяциях крупного рогатого скота мутации MSTN лежат в основе фенотипа двойной мускулатуры. Миостатин (также известный как фактор дифференцировки роста 8, сокращенно GDF8) представляет собой белок, который кодируется геном MSTN. Миостатин – это миокин, который вырабатывается и высвобождается миоцитами и действует на мышечные клетки, подавляя рост мышц. Животные с выключенным MSTN демонстрируют значительно более высокую мышечную массу. Оценка нокаутов MSTN, как правило, различается: в некоторых исследованиях сравниваются масса тела при рождении, соотношение массы тела к мышечной массе, количество мышечных волокон, мышечная масса и размер мышц у отредактированных и неотредактированных животных (использовались ZFN, TALEN и CRISPR/Cas9). Исследования с оценкой фенотипов, отредактированных по MSTN, свиней, показали повышенную массу тела при рождении, соотношение массы тела к мышечной массе, равное 170% от такового у нередактированных линий, увеличение мышечной массы на 100% [16]. В других исследованиях сообщалось об выраженном фенотипе двойной мускулатуры или значительно более крупных мышцах [17]. Сравнительно меньше исследований по нокауту MSTN было проведено у крупного рогатого скота, хотя в двух из них показано получение выраженного фенотипа двойной мускулатуры [1]. Однако, в этом случае, у крупного рогатого скота возникали проблемы с воспроизводством, в частности, с рождением.
Ускоренный рост и увеличение массы тела до 60% были подтверждены у овец и у коз. В ряде исследований редактировали козлов и кроликов. У обоих видов наблюдалось увеличение соотношения массы бицепсов и квадрицепсов более чем на 50%, но у кроликов еще отмечено наличие очень больших языков и низкая выживаемость. В других исследованиях у коз таргетировали ген FGF5 в дополнение к MSTN или встраивали ген fat-1 в локус MSTN.
MSTN также редактировали у нескольких водных видов: первый наследуемый нокаут MSTN у аквакультурных видов был осуществлен методом ZFN в 2011 году. Позднее методы TALEN и CRISPR/Cas9 использовали для редактирования карпа, тетраплоидного вида, где в дополнение к увеличенной мышечной массе присутствовали серьезные дефекты костей. Успешное редактирование у ряда видов аквакультуры, таких как сом, привело к увеличению массы тела мальков на 29,7%. У красного морского леща мышечная масса увеличилась на 16%, у морского леща – на 7%. Кроме рыбы, также опубликованы результаты успешного выключения MSTN у тихоокеанских устриц, основного двустворчатого моллюска аквакультуры [1].
Несмотря на то, что редактирование MSTN кажется весьма многообещающим для повышения продуктивности животных, необходимо также учитывать недостатки этого гена-мишени. Например, увеличенный вес при рождении отредактированных животных может приводить к осложнениям в родах, а жизнеспособность оказалась проблемной по данным нескольких исследований [16]. Точная настройка мутаций MSTN, выходящая за рамки полного нокаута, по мнению исследователей, может помочь оптимизировать использование этого гена в целях рационального природопользования.
Повышение продуктивности животноводства за счет изменения соотношения полов
Редактирование генов домашнего скота использовали также для изменения соотношения полов в потомстве. Во многих производственных схемах требуется только один пол (например, цыплята-самки в кладке яиц). Увеличение соотношения предпочитаемого пола в потомстве означает снижение затрат и сокращение территории, выделяемой для выращивания животных. При редактировании кур использовали CRISPR/Cas9 для вставки флуоресцентного белка в половые хромосомы самцов, что позволяло определять пол во время эмбриогенеза [18]. Была разработана система получения потомства исключительно женского пола у мышей путем воздействия исключительно на мужские гены с возможностью передачи другим видам млекопитающих [1]. Сегодня улучшение технологий определения пола и смещения пола, в целях экономии земель и ресурсов в животноводстве является одним из самых актуальных направлений исследования [19]. Также изучаются возможности увеличения численности в помете в целом: путем мутации гена GDF9 удалось увеличить численность в помете у коз.
Повышение питательных качеств продукции животноводства
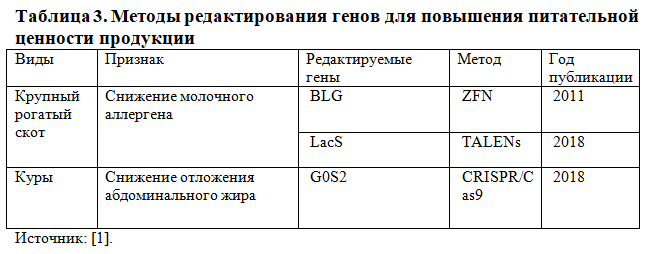
Помимо повышения продуктивности исследования, проведенные на домашнем скоте, показали, что редактирование генов может увеличить количество желаемых пищевых метаболитов и снизить концентрацию антинутриентов так, чтобы их содержание было сбалансированным и благоприятным для здоровья человека (Таблица 3).
Редактирование генов успешно применили, чтобы ограничить накопление в кукурузе антинутриентов, таких как фитиновая кислота, которая нарушает питание животных с однокамерным желудком. Чтобы смягчить негативное воздействие фитиновой кислоты на абсорбцию железа, цинка и кальция, методами CRISPR/Cas9 и ZFN были получены мутации генов, участвующих в биохимическом пути фитиновой кислоты. Успешный результат стал доказательством потенциальной пользы генной инженерии для смягчения антинутритивных эффектов. В сорго, важной продовольственной культуре в районах, подверженных засухе, основной класс запасных белков, называемый кафиринами, приводит к плохой усвояемости белка. Воздействуя на гены, синтезирующие кафирины, исследователи снизили уровень кафирина и улучшили усвояемость белка [15].
У кур редактирование генов привело к улучшению питательных свойств за счет снижения содержания жира. Таргетирование методом CRISPR/Cas9 гена GOS2, который влияет на катаболизм липидов, позволило получить цыплят с резко сниженным отложением жира в брюшной полости без каких-либо побочных эффектов [20]. Как упоминалось ранее, выключение fat-1 у свиней повысило пищевую ценность свинины за счет повышения накопления полезных жирных кислот. Редактирование генов применили и для снижения аллергенности таких продуктов глобальной значимости, как молоко и пшеница [1].
ОГРАНИЧЕНИЯ И ВОЗМОЖНОСТИ ГЕН-РЕДАКТИРОВАНИЯ В ЖИВОТНОВОДСТВЕ
Редактирование генов у сельскохозяйственных животных сегодня нацелено на получение новых признаков, которые могут прямо или косвенно повысить производительность отрасли (таблицы 1–4). Редактирование генов в сочетании с внутри-, цис- и трансгенными подходами считается наиболее эффективным.
Комбинирование генетических элементов организмов, несовместимых по половому признаку, могут привести к появлению, как нового «полезного» признака, так и усилить существующий. Например, у коров введение гена устойчивости мышей с помощью TALEN повышало устойчивость к туберкулезу. При этом, в животноводстве самым большим препятствием для редактирования является производство гомозиготных немозаичных животных с отредактированными генами. В настоящее время существуют два метода создания отредактированных эмбрионов перед их подсадкой суррогатной матери. Первый использует перенос ядра соматической клетки (SCNT, Somatic Cell Nuclear Transfer) из отредактированной клеточной линии для получения отредактированного эмбриона. Второй – использует прямое редактирование зиготы. В первом случае секвенирование может быстро подтвердить гомозиготные изменения до имплантации эмбриона, но оно обременено низкой эффективностью SCNT. Заводчики могут отказаться от SCNT, но в этом случае невозможно проверить гомозиготные изменения до рождения животного [21]. Сочетание последних открытий в области генной инженерии и усовершенствованных технологий размножения крупного рогатого скота (например, культивирование эмбрионов in vitro) позволяет редактировать геном непосредственно в оплодотворенных яйцеклетках с использованием синтетических высокоспецифичных эндонуклеаз. РНК-управляемые эндонуклеазы: кластеризованные с регулярным чередованием короткие палиндромные повторы, ассоциированные с Cas9 (CRISPR/Cas9), являются новым инструментом, еще больше расширяющим спектр доступных методов. В частности, эндонуклеазы, сконструированные CRISPR/Cas9, позволяют использовать множество направляющих РНК для одновременного нокаута за один этап путем прямой цитоплазматической инъекции зигот млекопитающих.
Возможности решения проблемы изменения климата с помощью редактирования генов расширяются по мере появления новых методик. Так, например, разрабатываются альтернативы традиционному белку редактирования Cas9. Ученые исследуют модификаторы эпигенома, которые изменяют ДНК и экспрессию генов, а также выполняют точную вставку ее коротких фрагментов. Есть новые методы, позволяющие повысить скорость гомологичной рекомбинации, которая в настоящее время является основным ограничением у растений.
Редактирование генов в сочетании с подходами IT-технологий считается особенно перспективным, однако пока отсутствие нормативной базы и законодательного регулирования не позволяет в полной мере применить эти методы в сельском хозяйстве. Также, необходимо изучение последствий применения генных манипуляций и отложенных эффектов.
Вместе с тем, благодаря параллельному развитию одноклеточной транскриптомики, редактированию генома и новым моделям стволовых клеток мы вступаем в совершенно новый с научной точки зрения период, когда функциональная генетика больше не ограничивается моделями растений, а может быть выполнена непосредственно на образцах животных и даже человека.
ВЫВОДЫ
- Разработаны различные технологии ген-редактирования растений и животных для адаптации к климатическим изменениям. Эти технологии могут использоваться как отдельные, самостоятельные, так и для решения целевых глобальных задач.
- Получены культуры растений и породы животных, устойчивых к абиотическому стрессу, к инфекциям, с повышенным уровнем урожайности и продуктивности.
- Для редактирования генов у растений и животных в основном применялась технология CRISPR/Cas9. Технология CRISPR обладает меньшей точностью по сравнению с технологией TALEN. Было доказано, что это самый быстрый и дешевый метод, который стоит менее двухсот долларов и занимает несколько дней. CRISPR также требует наименьшего количества знаний в области молекулярной биологии, поскольку технология основана на РНК, а не на белках.
- Однако, существуют некоторые опасения, связанные с новейшими генетическими технологиями. Это связано с нецелевой активностью ферментов, применяемых в ген-редактировании, что может вызвать потенциально опасные последствия на генетическом и организменном уровнях.
- Были получены данные по технологии ZFN, которые продемонстрировали большую цитотоксичность, чем метод TALEN, в то время как TALEN и РНК-управляемые подходы, как правило, обладают наибольшей эффективностью и меньшим количеством побочных эффектов [22].
- Несмотря на успешные результаты ряда исследований, генные технологии, применяемые для адаптации организмов при изменении климата, еще не перешли на практический уровень и вызывают большие опасения. Их внедрение сдерживается нормативно-правовыми ограничениями, социальными барьерами, политическими запретами и биоэтическими нормами.
Список источников
- Nicholas G. Karavolias, Wilson Horner, Modesta N. Abugu, Sarah N. Evanega. (2021). Application of Gene Editing for Climate Change in Agriculture. Frontiers, Vol. 5, https://doi.org/10.3389/fsufs.2021.685801
- Method of the year 2011. Nat. Methods, (2012), doi: 10.1038/nmeth.1852
- And Science’s 2015 Breakthrough of the Year is… Science (2015)
- Church G. «The future of genetic codes and BRAIN codes». (2017). YouTube NIHvcast
- Khalil, A. M. (2020). The genome editing revolution: review. J. Genet. Eng. Biotechnol. 18:68. doi: 10.1186/s43141-020-00078-y
- Rojas-Downing, M. M., Nejadhashemi, A. P., Harrigan, T., and Woznicki, S. A. (2017). Climate change and livestock: impacts, adaptation, and mitigation. Clim. Risk Manag. 16, 145–163. doi: 10.1016/j.crm.2017.02.001
- Porto-Neto, L. R., Bickhart, D. M., Landaeta-Hernandez, A. J., Utsunomiya, Y. T., Pagan, M., Jimenez, E., et al. (2018). Convergent evolution of slick coat in cattle through truncation mutations in the prolactin receptor. Front. Genet. 9:57. doi: 10.3389/fgene.2018.00057
- Scudellari, M. (2019). Self-destructing mosquitoes and sterilized rodents: the promise of gene drives. Nature 571, 160–162. doi: 10.1038/d41586-019-02087-5
- Koslov,á, A., Trefil, P., Mucksov,á, J., Reinišov,á, M., Plach,ý, J., Kalina, J., et al. (2020). Precise CRISPR/Cas9 editing of the NHE1 gene renders chickens resistant to the J Subgroup of avian leukosis virus. Proc. Natl. Acad. Sci. U.S.A. 117, 2108–2112. doi: 10.1073/pnas.1913827117
- Wu, H., Wang, Y., Zhang, Y., Yang, M., Lv, J., Liu, J., et al. (2015). TALE nickase-mediated SP110 Knockin endows cattle with increased resistance to tuberculosis. Proc. Natl. Acad. Sci. U.S.A. 112, E1530–E1539. doi: 10.1073/pnas.1421587112
- Gao, Y., Wu, H., Wang, Y., Liu, X., Chen, L., Li, Q., et al. (2017). Single Cas9 nickase induced generation of NRAMP1 knockin cattle with reduced off-target effects. Genome Biol. 18:13. doi: 10.1186/s13059-016-1144-4
- Liu, X., Wang, Y., Tian, Y., Yu, Y., Gao, M., Hu, G., et al. (2014). Generation of mastitis resistance in cows by targeting human lysozyme gene to β-Casein locus using zinc-finger nucleases. Proc. Biol. Sci. 281:20133368. doi: 10.1098/rspb.2013.3368
- Whitworth, K. M., Rowland, R. R. R., Petrovan, V., Sheahan, M., Cino-Ozuna, A. G., Fang, Y., et al. (2019). Resistance to coronavirus infection in amino peptidase N-Deficient pigs. Transgenic Res. 28, 21–32. doi: 10.1007/s11248-018-0100-3
- Xie, Z., Pang, D., Yuan, H., Jiao, H., Lu, C., Wang, K., et al. (2018). Genetically modified pigs are protected from classical swine fever virus. PLOS Pathog. 14:e1007193. doi: 10.1371/journal.ppat.1007193
- Li, M., Ouyang, H., Yuan, H., Li, J., Xie, Z., Wang, K., et al. (2018). Site-specific Fat-1 knock-in enables significant decrease of n-6PUFAs/n-3PUFAs ratio in pigs. G3 Genes Genomes Genet. 8, 1747–1754. doi: 10.1534/g3.118.200114
- Rao, S., Fujimura, T., Matsunari, H., Sakuma, T., Nakano, K., Watanabe, M., et al. (2016). Efficient modification of the myostatin gene in porcine somatic cells and generation of knockout piglets. Mol. Reprod. Dev. 83, 61–70. doi: 10.1002/mrd.22591
- Wang, K., Tang, X., Xie, Z., Zou, X., Li, M., Yuan, H., et al. (2017). CRISPR/Cas9-mediated knockout of myostatin in chinese indigenous erhualian pigs. Transgenic Res. 26, 799–805. doi: 10.1007/s11248-017-0044-z
- Lee, H. J., Yoon, J. W., Jung, K. M., Kim, Y. M., Park, J. S., Lee, K. Y., et al. (2019). Targeted gene insertion into Z chromosome of chicken primordial germ cells for avian sexing model development. FASEB J. Off. Publ. Fed. Am. Soc. Exp. Biol. 33, 8519–8529. doi: 10.1096/fj.201802671R
- CSIRO (2021). Sex Determination Techniques for the Egg and Poultry Industries. Available online at: https://www.csiro.au/en/research/production/biotechnology/chicken-sex-selection (дата обращения октябрь 2023 г.).
- Park, T. S., Park, J., Lee, J. H., Park, J.-W., and Park, B.-C. (2019). Disruption of G0/G1 Switch Gene 2 (G0S2) reduced abdominal fat deposition and altered fatty acid composition in chicken. FASEB J. 33, 1188–1198. doi: 10.1096/fj.201800784R
- Bishop, T. F., and Eenennaam, A. L. V. (2020). Genome editing approaches to augment livestock breeding programs. J. Exp. Biol. 223 (Suppl 1): doi: 10.1242/jeb.207159
- Kim H., Kim JS (May 2014). “A guide to genome engineering with programmable nucleases». Nature Reviews. Genetics. 15 (5): 321-34. doi:10.1038/nrg3686. PMID 24690881. S2CID 9373606.
- ipcc.ch (2023) Sixth Assessment Report (accessed November 2023)
- https://www.ncbi.nlm.nih.gov/pubmed. (accessed November 2023)
Для цитирования: Жиганова Л.П. Применение генной инженерии для решения проблемы изменения климата в животноводстве // Московский экономический журнал. 2023. № 11. URL: https://qje.su/rekreacia-i-turizm/moskovskij-ekonomicheskij-zhurnal-11-2023-51/
© Жиганова Л.П., 2023. Московский экономический журнал, 2023, № 11.