Московский экономический журнал 10/2020

УДК 639.446
DOI 10.24411/2413-046Х-2020-10685
ПРИМЕНЕНИЕ БИОХИМИЧЕСКИХ МАРКЕРОВ ДЛЯ ОЦЕНКИ УСТОЙЧИВОСТИ МАРИКУЛЬТУРНЫХ ХОЗЯЙСТВ
APPLICATION OF BIOCHEMICAL MARKERS TO ASSESS THE SUSTAINABILITY OF MARICULTURE FARMS
Работа выполнена в рамках госбюджетной темы ААА-А20-120031790021-8 и частично в рамках госбюджетной темы ААА-А17-117030110038-5
Довженко Н.В., Дальневосточный государственный технический рыбохозяйственный университет; Тихоокеанский океанологический институт им. В. И. Ильичева ДВО РАН
Слободскова В.В., Дальневосточный государственный технический рыбохозяйственный университет; Тихоокеанский океанологический институт им. В. И. Ильичева ДВО РАН
Жадько Е.А., Дальневосточный государственный технический рыбохозяйственный университет
Пряжевская Т.С., Дальневосточный государственный технический рыбохозяйственный университет
Dovzhenko N.V., Slobodskova V.V., ZHadko E.A., Priazhevskaia T.S.
Аннотация. Исследованы разновозрастные группы приморского гребешка Mizuhopecten yessoensis (Jay, 1857), культивированного садковым и донным способами. В работе были применены биохимические маркеры окислительного стресса: степень повреждения ДНК (индекс генетического повреждения (ИГП)), содержание продуктов перекисного окисления липидов (МДА и основания Шиффа), и общая антирадикальная активность в тканях моллюсков (индекс интегральной антирадикальной активности (ИАА)). Показано, что с возрастом в жабрах и пищеварительной железе гребешков, выращенных разными способами, уровень ТБК-реактивных продуктов (МДА) увеличивается. Уровень конечных продуктов ПОЛ (основания Шиффа (ОШ)) в клетках жабр донных и садковых моллюсков отличается не значительно. В тканях гребешков, выращенных донным способом, уровень продуктов ПОЛ (МДА и ОШ) был выше, чем у моллюсков из садков. Уровень ИАА в тканях гребешков с возрастом (3+) увеличивался. Характеристики ДНК-комет в клетках жабр и в пищеварительной железе гребешков возраста 2+ и 3+, отобранных из садков несколько выше, чем у моллюсков, культивируемых на дне акватории.
В комплексе данные биомаркеры отразили биохимическое состояние гидробионтов. Показана эффективность использования биомаркеров окислительного стресса для прогнозирования физиологической устойчивости выращиваемых в искусственных условиях моллюсков.
Summary. Biomarkers of oxidative stress were used to estimate the status of different age groups (2+, 3+) of the scallop Mizuhopecten yessoensis (Jay, 1857) cultivated by the cage and bottom methods.
In the work were used biochemical parameters: the degree of DNA damage, products of lipid peroxidation (malondialdehyde and Schiff bases), the total antiradical activities in cells of gills and digestive gland of Yesso scallop. Results of studies showed that the level of malondialdehyde and antiradical activities in tissues was grown according to age and to cultivation method.
The DNA damage in cells of gill and the digestive gland of scallops from cages is somewhat higher than in mollusks cultured at the bottom of the water area. The parameters of oxidative stress reflected the biochemical state of aquatic organisms. The efficiency of using biomarkers of oxidative stress for predicting the physiological stability of mollusks grown in artificial conditions has been shown.
Ключевые слова: приморский гребешок, марикультура, садки, жабры, пищеварительная железа, биомаркеры, повреждение молекулы ДНК, перекисное окисление липидов, антирадикальная активность.
Key words: Yesso scallop, sea-farming, gill, digestive gland, biomarkers, DNA demage, lipid peroxidation, antiradical activity.
Введение
Для марикультурных хозяйств Дальнего Востока, в частности, Приморского края, наиболее популярным в искусственном воспроизводстве и выращивании является приморский гребешок Mizuhopecten yessoensis (Jay, 1857). На сегодняшний день культивирование этого моллюска включает в себя несколько направлений, которые позволяют варьировать биотехниками выращивания в разных гидрологических условиях акваторий [1, 2, 3]. Однако, учитывая гидрохимические и гидрологические особенности бухт и заливов, где размещают гребешковые хозяйства, условия содержания моллюсков будут отражаться на их физиолого-биохимическом состоянии. Как известно, на первых этапах искусственного воспроизводства гребешка хозяйства несут значительные убытки, которые связаны с гибелью молоди. Как правило, это связывают с воздействием абиотических и биотических факторов среды. Также, все чаще, гребешковые хозяйства стали сталкиваться с массовой гибелью выращиваемых моллюсков на стадии товарного размера [4], которые приводят к финансовым потерям. Зачастую причиной этого становятся вирусные и бактериальные инфекции [5; 6], поражение экзо- и эндопаразитами, а также риккетсиозными и ассоциированными инфекциями [7; 8]. Кроме того, среди двустворчатых моллюсков M. yessoensis является уникальным видом по своим физиологическим особенностям, что также необходимо учитывать.
Поэтому для прогнозирования экономической устойчивости марикультурных хозяйств, в первую очередь, необходимо учитывать физиолого-биохимические критерии культивируемых гидробионтов. Именно биохимические показатели дают возможность выявить патологические изменения в организме на самой ранней стадии, сигнализируя о начале патологических процессов.
К объективным способам оценки физиолого-биохимического состояния объектов марикультуры можно отнести методы определения показателей развития окислительного стресса — накопление продуктов перекисного окисления липидов (ПОЛ), метод ДНК-комет и общий антиоксидантный статус клетки (индекс интегральной антирадикальной активности) — как интегральные показатели токсического воздействия факторов среды и маркеры антиоксидантной защиты.
Цель настоящей работы – показать эффективность использования биомаркеров окислительного стресса для прогноза устойчивости гидробионтов как в естественных экосистемах, так и в морских хозяйствах.
МАТЕРИАЛЫ И МЕТОДЫ
Моллюсков M. yessoensis в возрасте 2+ и 3+, искусственно культивированных на дне и в садках (бух. Круглая, залив Петра Великого), отбирали по 10 особей одинакового размера. Изолированные ткани пищеварительной железы и жабр гомогенизировали в стеклянном гомогенизаторе во льду при температуре 4 °С. Для гомогенизации тканей использовали 5мМ фосфатный буфер, рН 7.4. Ткани предварительно были препарированы и заморожены при температуре –80 °С. Навеску ткани брали из расчета разведения буфером 1:9 – на 1 г взвешенной ткани приходится 9 мл буфера.
Определение биохимических маркеров окислительного стресса (содержание малонового диальдегида и флуорисцирующих продуктов (основания Шиффа))
Количественное содержание ТБК-реактивных продуктов в ткани фиксировали по цветной реакции с 2-тиобарбитуровой кислотой [9]. Гомогенат фиксировали 30 % трихлоруксусной кислотой (ТХУ) и интенсивно встряхивали. Затем в пробу добавляли 0.75 % тиобарбитуровую кислоту (ТБК) с последующим термостатированием в водяной бане в течении 20 минут при температуре 95 °С. После термостатирования, охлажденные пробы центрифугировали при 3000 оборотах в течении 30 мин при температуре 20 °С. Оптическую плотность проб фиксировали на двухлучевом спектрофотометре Shimadzu UV-2550 при длине волн 532 / 580 нм. Количественное содержание продуктов ТБК выражается в нмоль / г сырого веса.
Содержание аддуктов с синей флуоресценцией (основания Шиффа), образующихся в процессе перекисного окисления липидов мембран, определяли спектрофлуориметрически [10]. Данные соединения составляют основную массу липофусциновых гранул. Пробоподготовка включает в себя экстракцию липидных компонентов из тканей смесью растворителей (метанол:хлороформ, соотношение объемов 1:2), расслоения пробы, сушки и регистрации хлороформ-метанольных экстрактов на спектрофлуориметре (Shimadzu PF-5301). Относительное содержание данных соединений выражали в условных единицах (УЕ) в расчете на 1 грамм сырого веса (относительно флуоресценции раствора 1 мкмоль/мл хинин-сульфата 0.1 H H2SO4).
Определение повреждения молекулы ДНК в клетке
В наших исследованиях мы использовали щелочной вариант кометного анализа [11], адаптированный к морским организмам [12].
Препарированные жабры и пищеварительную железу промывали холодной искусственной морской водой, не содержащей Ca2+ и Mg2+ (500 мM NaCl, 12,5 мМ KCl, 5 мM ЭДТА-Na2 и 20 мМ Tрис – HCl, pH 7.4) для удаления слизи. Затем для лучшего выделения клеток ткани измельчали и инкубировали 30-40 мин. После инкубации, для отделения крупных фрагментов, клеточную суспензию профильтровывали через мельничный газ, конечная концентрация клеток в суспензии составляла 105 кл. /мл.
К 100 мкл 1 % легкоплавкой агарозы (LKB, Швеция) добавляли 50 мкл полученной суспензии клеток, тщательно ресуспендировали и наносили на предметное стекло, накрывали покровным стеклом и переносили в холодильник для застывания геля на 3-5 мин. Затем образцы (слайды) помещали в лизирующий раствор (2.5M NaCl; 0.1M ЭДTA-Na2, 1 % Тритон X–100; 10 % ДМСО; 0.02 M Трис, pH 10) на 60 мин при температуре 4 °С в холодильную камеру. Щелочное раскручивание и электрофорез проводили также в холодильной камере. Затем препараты окрашивали этидиум бромидом (2мкг/мл). ДНК-комета – это клеточный геном, где РНК распадается в щелочных условиях, а комплекс «ДНК — краситель» при этом окрашивается и флуоресцирует.
Визуализацию и регистрацию ДНК-комет проводили на сканирующем флуоресцентном микроскопе (Zeiss, AxioImagerA1), снабженного цифровой фотокамерой AxioCamMRc. Для обработки полученных изображений использовали пакет программного обеспечения Comet Score Freewarev1.5 (http://www.autocomet.com/products_cometscore.php), позволяющий вычислять различные параметры комет с разной степенью повреждения ДНК. Для каждой кометы вычисляли % доли ДНК в хвосте кометы и индекс генетического повреждения (ИГП). ИГП суммируется из разных типов комет, которые классифицируют на 5 классов в зависимости от степени % повреждения ДНК в хвосте кометы — С0, С1, С2, С3, С4 (рис. 1) [13].
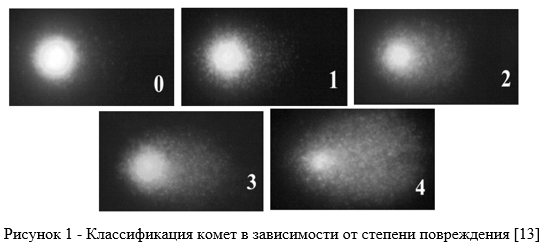
В каждой группе моллюсков были проанализированы по 10 слайдов (1 слайд = 1 особь). В каждом слайде присутствовало не менее 50 комет.
Определение антирадикальной активности образцов
Отфильтрованные гомогенаты центрифугировали при 10000 g (оборотах) в течение 40 мин, при температуре 4°С на центрифуге Sigma 216 PK (Sartorius). определяли Интегральную антиоксидантную активность (ИАА) в полученном супернатанте тканей определяли по их способности подавлять реакцию окисления ABTS [2,2’азинобис (3-этилбензотиазолин-6-сульфонат)] пероксильными и алкоксильными радикалами, образующимися при разложении ABAP [2,2’-азобис (2-метил-аминопропан) дигидрохлорид] при температуре 37 °С [14] Регистрацию антирадикальной активности проводили на двухлучевом спектрофотометре Shimadzu UV-2550 с термостатированной ячейкой при длине волны 734 нм. Уровень интегральной антирадикальной активности выражается в единицах тролокса на 1 мг белка.
Количественное определение белка в цитозоле определяется методом Лоури [15], основанный на механизме образования комплекса меди и белка в щелочном растворе, который затем восстанавливается реактивом Фолина-Чаколтеу. Оптическую плотность проб замеряли на двухлучевом спектрофотометре Shimadzu UV-2550 при длине волн 720 / 750 нм.
Статистическая обработка полученных результатов проводилась с использованием пакета прикладных программ STATISTICA 6.0 и Microsoft Excel 2016. Оценку результатов проводили по каждому эксперименту путем сравнения среднегрупповых показателей (Р<0,01 с использованием критерия Манна-Уитни).
Результаты и обсуждение
ТБК-реактивные продукты. Как известно, клеточные мембраны содержат ненасыщенные липиды, которые являются первостепенными мишенями для свободных радикалов. В результате окисления мембранных липидов наблюдается изменение их структуры, происходит нарушение мембранного транспорта, изменение активности мембранных белков. Перекисное окисление липидов – это очень сложный процесс, растянутый на несколько стадий, где происходит образование и деградация липидных радикалов. Также этот процесс сопровождается формированием таких соединений как кетоны, спирты, эфиры, альдегиды и мн. др. [16]. Как правило, модифицированные липидные молекулы являются маркерами острого воздействия на организм, априори, окислительного стресса (ОС). К наиболее распространенным маркерам ОС относят продукты перекисного окисления липидов (продукты ПОЛ). Одним из них является конечный продукт ПОЛ – ТБК-реактивный продукт — МДА [17]. ТБК- реактивные продукты опасны своей относительной стабильностью. Кроме того, они способны проникать внутрь клетки, выходить из нее и атаковать молекулы и соединения далеко от того места, где генерируются. Также малоновый дальдегид может проявлять цито- и генотоксическое действия [18].
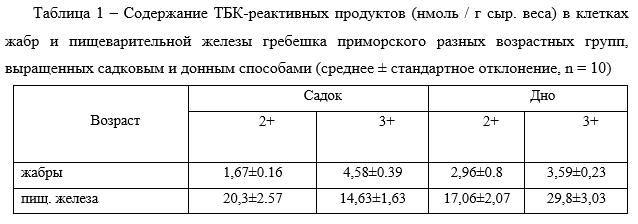
Результаты наших исследований показали, что с возрастом в жабрах гребешков, выращенных разными способами, наблюдается тенденция к увеличению содержания ТБК-реактивных продуктов: в жабрах гребешков 2+ и 3+, выращенных донным способом — 2,96 ±0,8 нмоль / г сыр. веса и 3,59 ± 0,23 нмоль / г сыр. веса соответственно; в садках — 1,67 ± 0,16 нмоль / г сыр. веса и 4,58 ± 0,39 нмоль / г сыр. веса соответственно. Также необходимо отметить, что у двухлетних гребешков из садков уровень МДА почти в 2 раза ниже, чем у моллюсков, выращенных донным способом.
В клетках пищеварительной железы гребешков, выращенных донным способом, с возрастом количество ТБК-реактивных продуктов увеличивалось, а у гребешков из садков снижалось (табл. 1). Содержание ТБК-реактивных продуктов в пищеварительной железе гребешков 2+ и 3+, выращенных донным способом, составляло 17,06 ± 2,07 нмоль / г сыр. веса и 29,8 ± 3,03 нмоль / г сыр. веса соответственно; в садках – 20,3 ± 2,57 нмоль / г сыр. веса и 14,63 ± 1,63 нмоль / г сыр. веса соответственно. Отмечено, что в клетках пищеварительной железы гребешков, выращенных донным способом, уровень МДА в 2 раза выше, чем у моллюсков, из садков.
Основания Шиффа. Среди конечных продуктов ПОЛ выделяют флуорисцирующие конъюгаты типа оснований Шиффа. Эти соединения биологически активны и устойчивы.
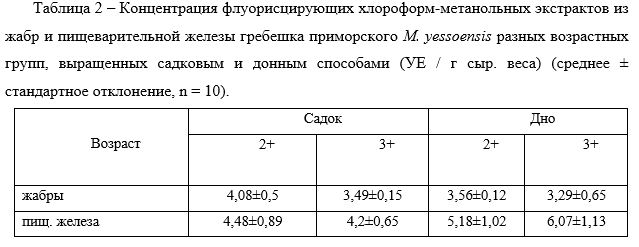
В жабрах гребешков, выращенных разными способами, уровень конечных продуктов ПОЛ значительно не отличался: в жабрах гребешков 2+, 3+, выращенных донным способом — 3,56 ± 0,12 УЕ / г сыр. веса и 3,29±0,65 УЕ / г сыр. веса соответственно; в садках — 4,08±0,5 УЕ / г сыр. веса и 4,2±0,65 УЕ / г сыр. веса соответственно. В клетках пищеварительной железы гребешков, выращенных донным способом наблюдались повышенные значения ОШ, по сравнению с садковыми гребешками (табл. 2).

Таким образом было отмечено, что активность антирадикальной защиты в клетках жабр двухлетних гребешков ниже в 2 – 2,5 раза, чем у трехлетних, при этом существенных отличий уровня ИАА между донными и садковыми особями отмечено не было. В пищеварительной железе также отмечены возрастные изменения антирадикальной активности в сторону увеличения, что, вероятно указывает на стабилизацию работы антиоксидантной системы моллюска.
Оценка повреждения ДНК в тканях гребешка приморского разных возрастных групп, выращенных садковым и донным способами. Рассчитанные усредненные данные ДНК-комет с помощью компьютерной программы (% доля ДНК в «хвосте» кометы и индекс генетического повреждения — ИГП) представлены в таблице 4. Полученные характеристики ДНК-комет указывают на степень повреждения молекулы ДНК индивидуальных клеток жабр и пищеварительной железы гребешков приморских, в зависимости от возраста моллюска и его местообитания в исследуемой акватории (садок/дно).
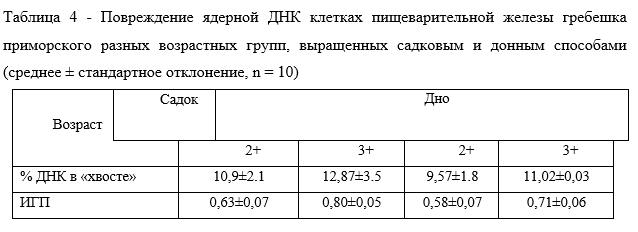
В обычных условиях, в отсутствии повреждающих и стрессовых факторов, значение ИГП в клетках не превышает единицы, в среднем составляя 0,8-1,0 [20]. Полученные результаты для гребешков из садков и со дна также не превышают 1. Явных различий по уровню повреждения ДНК в клетках исследованных гребешков, отобранных как с хозяйства марикультуры, так и из природной популяции выявлено не было.
Однако показатели поврежденности ДНК в клетках жабр и в пищеварительной железе гребешков возраста 2+ и 3+, отобранных из садков несколько выше, чем у моллюсков, обитающих на дне бухты. Этот факт свидетельствует о том, что моллюски, находясь в естественных условиях, не ограничены, и не находящиеся в скученности, обитают более в комфортных условиях.
Таким образом, полученные данные по уровню повреждения ДНК клеток жабр и пищеварительной железы M. yessoensis показали, что у 2-х групп гребешков, культивируемых разными способами, практически не отличаются.
В настоящее время существуют несколько способов воспроизводства гребешка, среди которых технологии выращивания в подвесных садках и на дне. При выполнении ряда требований в технологии выращивания и без оседания садков на грунт, в зимний период выживаемость приморского гребешка в подвесных садках составляет 92-95%. При выращивании гребешка донным способом выживаемость моллюска зачастую составляет менее 50% [1; 2; 3]. Несмотря на это, марикультурные хозяйства идут на риски, снижая капиталовложения, и применяют комбинированные технологии выращивания, включая более дешевый, донный способ. Товарного размера приморский гребешок достигает в возрасте 2,5 – 3 года. Именно в этом возрасте моллюск считается уязвимым по физиолого-биохимическим показателям. Чтобы избежать риска потери выращиваемой продукции нашей задачей было исследовать основные маркеры окислительного стресса, вероятность развития которого в этот период у приморского гребешка велика.
При сравнении показателей МДА в клетках пищеварительной железы у садковых гребешков разных возрастов, высокое содержание МДА у «двухлетних» можно объяснить нестабильностью работы антиоксидантной системы именно в этом возрастном диапазоне. Авторами разных исследований было показано, что такие физиологические изменения, как соматический рост, половое созревание, старение организма, интенсивно запускают генерацию оксирадикалов в клетках [21; 22; 23; 24; 25; 26]. В период достижения половой зрелости (у искусственно культивируемого приморского гребешка это возраст 2 года), наблюдается пик активного роста, где характерны высокие скорости обмена веществ, потребления кислорода и, как следствие, увеличение образования свободных радикалов в клетках [27, 28]. Антиоксидантная система в этот период находится в стадии перестройки с ювенильной стадии на половозрелую, происходит первое созревание половых продуктов, которое также требует от организма высоких энергетических и метаболических затрат. Таким образом подготовка моллюсков к первому нересту в возрасте 2 лет ведет к развитию окислительного стресса в организме, что отражается и на антирадикальной активности, то есть ее снижению. Выращиваемый донным способом гребешок приближен к естественным условиям и сроки его созревания сдвигаются к 3 годам [29]. Физиологическая и биохимическая и стабильность у M. yessoensis наблюдается уже после второго нереста (в возрасте 3+ — 4+), когда организм окончательно перестроился с растущего на половозрелый этап жизнедеятельности. Поэтому, мы наблюдаем высокие показания МДА в жабрах и пищеварительной железе у моллюсков в возрасте 2+, связанные с физиологией моллюсков в совокупности с более низкой, по сравнению с садковым содержанием, концентрацией растворенного кислорода в воде и активной аккумуляцией микроэлементов из придонных водных слоев и грунтов. На основе этих результатов можно полагать, что параллельно происходит накопление токсичных продуктов метаболизма, типа оснований Шиффа. Однако, основываясь на полученных нами результатах, видимых возрастных изменений у двух- и трехлетних гребешков не наблюдается. В этом возрасте у приморского гребешка происходит активный соматический рост, созревание гонад, что не является физиологической старостью для организма и накопление продуктов ПОЛ в клетках, в том числе липофусцина, является обычным процессом, а не патологией. Этот же факт подтверждают полученные нами результаты по повреждению ДНК, где нет видимых возрастных отличий ИГП в клетках жабр у особей 2+ и 3+.
Таким образом, мы показали, что в двух близко расположенных возрастных группах гребешка, отличающихся способом выращивания, значения МДА и ИАА, отражающие развитие окислительных процессов и различных патологических изменений в организме достоверно отличаются. Если не рассматривать пагубное воздействие абиотических и биотических факторов среды на выращиваемых гребешков, накопление флуорисцирующих продуктов ПОЛ и повреждение молекулы ДНК в клетках происходит по мере изменения физиологических процессов в организме, и, в первую очередь старения. Разница в возрасте гребешков в 1 год не отражается в значительном изменении содержания оснований Шиффа в клетках и в повреждении молекулы ДНК. Кроме того, активное накопление флуорисцирующих продуктов и наибольшее их содержание отмечается в митотически неактивных клетках [10].
Заключение
В данной работе мы показали эффективность использования биомаркеров окислительного стресса для прогнозирования физиологической устойчивости выращиваемых моллюсков в искусственных условиях. В комплексном исследовании наиболее информативными показали себя биомаркеры МДА и ИАА, а вспомогательными экспресс-маркерами, отражающие патологические процессы в организме — ИГП и содержание флуорисцирующих продуктов ПОЛ. В комплексе данные биомаркеры наиболее полно могут дать информацию о биохимическом состоянии гидробионтов, для прогноза устойчивости как естественных экосистема, так и морских хозяйств.
По нашему мнению, приморский гребешок, выращиваемый как донным, так и садковым способом является физиологически уязвимым в возрасте 2+ — 3+.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
- Седова Л.Г., Соколенко Д.А. Численность и размерный состав поселений приморского гребешка в заливе Петра Великого (Японское море) // Известия ТИНРО. — 2014. — Т. 179. — С. 226–235.
- Гаврилова Г.С., Кучкрявенко А.В., Одинцов А.М. Результаты и перспективы культивирования приморского гребешка в зал. Владимира (Японское море) // Известия ТИНРО. — — Т. 147. — С. 385-396.
- Гаврилова Г.С., Сухин И.Ю., Турабжанова И.С. Первый опыт садкового выращивания заводской молоди гребешка (Mizuhopecten yessoensis) у восточного побережья Приморья // Известия ТИНРО. – 2019. — Т. 197. — С. 208-218.
- Xiao J., Ford S.E., Yang H., Zhang G., Zhang F., Guo X. Studies on mass summer mortality of cultured zhikong scallops (Chlamys farreri Jones et Preston) in china //Aquaculture. — 2005. – V. 250. — № 3-4. — P. 602-615.
- Zhang X., Zhu M., Li R., Wang Z., Xia B., Zhang L. Density-dependent mortality of the scallop Chlamys farreri in grow-out cuture // Aquaculture research. — 2006. — № 37. — P. 842-844.
- Read P.A., Fernandes T.F. Management of environmental impacts of marine aquaculture in Europe// Aquaculture. — 2003. — V. 226. — P. 139-163.
- Lan Y., Ye T., Xue Y., Liu H., Zhang H., Cheng D., Zhao M., Zhang Y., Li S., Ma H., Zheng H. Phyiological and immunological responses to mass mortality in noble scallop Chlamys nobilis cultured in Nan’ao waters of Shantou, China // Fish and Shellfish Immunology. — 2018. — № 82. — P. 453–459.
- Chao L., Fucun W.U., Huayong Q., Guofan Z. Relationships of growth and mortality to enzymatic activity, and the relative mRNA expression of cultured scallops Patinopecten yessoensis in the Yellow Sea, China // Journal of Oceanology and Limnology. — 2019. — V. 37, № 4. — P. 1409-1422
- Liochev S.I. Reactive Oxygen Species and the Free Radical Theory of Aging // — 2013 — V. 13. — P. 1-4
- Shimasaki H. Assay of fluorescent lipid peroxidation products // Methods in Enzymology— 1994. — 233. — P. 338-346
- Бельчева Н.Н., Кудряшова Ю.В., Истомина А.А., Чижова Т.Л. Возрастное изменение реакций антиоксидантных ферментов в жабрах приморского гребешка Mizuhopecten yessoensis на окислительный стресс // Вопросы рыболовства. — 2014. — Т. 15. — № 3. — С. 306-313
- Filomeni G., De Zio D., Cecconi F. Oxidative Stress and Autophagy: The Clash Between Damage and Metabolic Needs // Cell Death and Differentiation. – 2015. — V. 22. — № 3. — P. 377-388
- Luo H., Chiang H., Louw M., Susanto A., Chen D. Nutrient Sensing and the Oxidative Stress Response // Trends in Endocrinology and Metabolism. – 2017. — V. 28. № 6. — P. 44-460
- Gorrini C., Harris I.S., Mak T.W. Modulation of Oxidative Stress as an Anticancer Strategy // Nature Reviews Drug Discovery -2013 — 12. — № 12. — P. 931-47
- Ighodaro O.M. Molecular Pathways Associated with Oxidative Stress in Diabetes Mellitus // Biomedicine and Pharmacotherapy — 2018 — 108. — P. 656-662
- Тюлькова Н.А., Бондарь В.С. Содержание диеновых конъюгатов и оснований Шиффа в мицелии гриба Neonothopanus nambi при разных уровнях его свечения в условиях стресса // Вестник КрасГАУ. — 2019. — №3. — С. 37-44)
- Sies H. Oxidative stress: oxidants and antioxidants. London: Academic Press Limited. — 1991. — 650 p.
- Болдырев А.А. Окислительный стресс и мозг // Соросовский Образ. Журн. — 2001. — Т. 7. — № 4. — С. 21-28
- Storey K.B. Oxidative stress: animal adaptations in nature Brasil // J. Med. Biol. Res. — 1996. — V. 29. — P. 1715–1733
- Слободскова В.В., Кукла С. П., Челоми В. П. Анализ качества морской среды на основе определения генотоксичности ДНК клеток жабр приморского гребешка Mizuhopecten yessoensis (Jay, 1856)// Биология моря. — 2015. — Т. 41. — № 6. — С. 457-460
- Soldatov A.A., Gostyukhina O.L., Golovina I.V. Antioxidant enzyme complex of tissues of the bivalve Mytilus galloprovincialis Lam. under normal and oxidative-stress conditions: A review // Applied Biochemistry and Microbiology. — 2007. — V. 43. — № 5. — P. 556-562.
- Бельчева Н.Н., Силина А.В., Слинько Е.Н., Челомин В.П. Сезонная изменчивость уровней Fe, Zn, Cu, Mn и Cd в гепатопанкреасе приморского гребешка Mizuhopecten yessoensis // Биология моря. – 2002. — Т.28. — № 6. — С. 442-448.
- Abele D., Brey T., Philipp E. Bivalve models of aging and the determination of molluscan lifespans // Experimental Gerontology. — 2009. — V. 44. — P. 307–315
- Gonzales P. M., Eilhelms-Dick D., Abele D., Puntarulo S. Iron in coastal marine ecosystems: role in oxidative stress in aquatic ecosystems: 1st ed. Blackwell Publishing. — 2012. — Ch. 8. — P. 115-125.
- Bize P., Devevey G., Monhagan P., Doligez B., Christe P. Fecundity and survival in relation to resistance to oxidative stress in a free living bird // Ecology. — 2008. — V. 89. — P. 2584–2595.
- Guerra C., Zenteno-Savín T., Maeda-Martínez A.N., Philipp E.E.R., Abele D. Changes in oxidative stress parameters in relation to age, growth and reproduction in the short-lived catarina scallop Argopecten ventricosus reared in its natural environment // Comparative Biochemistry and Physiology, Part A. — 2012. — V. 162. — P. 421–430.
- Приморский гребешок. Институт биологии моря. Владивосток: ДВНЦ АН СССР. – 1986. — 244 с. (монография)
- Силина А.В. Популяция приморского гребешка при климатических и антропогенных изменениях среды в Амурском заливе Японского моря // Океанология. – 2019. – Т. 59. — № 1. — С. 82-92.
- Nussey D., Pemberton J., Pilkington J. G., Blount J. Life history correlates of oxidative damage in a free-living mammal population // Funct Ecol. — 2009. — V. 23. — P. 809–817.