
УДК 574.21:574
DOI 10.24411/2413-046Х-2019-10168
БИОМОНИТОРИНГ КРУПНЫХ СКОПЛЕНИЙ CORBICULA JAPONICA (Prime, 1864) В ЗАЛИВЕ ПЕТРА ВЕЛИКОГО (ЯПОНСКОЕ МОРЕ)
BIOMONITORING OF LARGE CLUSTERS OF THE COMMERCIAL MOLLUSC CORBICULA JAPONICA (PRIME, 1864) IN PETER THE GREAT BAY (THE SEA OF JAPAN)
Благодарности. Авторы выражают благодарность старшему научному сотруднику ТОИ ДВО РАН Семкину П.Ю. за помощь в построении карты-схемы района работ.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Соблюдение этических норм. При проведении экспериментов соблюдались правила обращения с экспериментальными животными.
Финансирование. Работа выполнена при финансовой поддержке госбюджетной темы ААА-А19-119032090011-7 и частичной поддержке госбюджетной темы ААА-А17-117030110038-5.
Довженко Н.В., ФГБОУ ВПО Дальневосточный технический государственный рыбохозяйственный университет, Владивосток; Тихоокеанский океанологический институт им. В.И. Ильичева ДВО РАН, Владивосток
Слободскова В.В., ФГБОУ ВПО Дальневосточный технический государственный рыбохозяйственный университет, Владивосток; Тихоокеанский океанологический институт им. В.И. Ильичева ДВО РАН, Владивосток
Матросова И.В., ФГБОУ ВПО Дальневосточный технический государственный рыбохозяйственный университет, Владивосток
Колосова Л.Ф., Тихоокеанский океанологический институт им. В.И. Ильичева ДВО РАН, Владивосток
Кукла С.П., Тихоокеанский океанологический институт им. В.И. Ильичева ДВО РАН, Владивосток
Пряжевская Т.С., ФГБОУ ВПО Дальневосточный технический государственный рыбохозяйственный университет, Владивосток
Мазур А.А., Тихоокеанский океанологический институт им. В.И. Ильичева ДВО РАН, Владивосток
e-mail: nadezhda-@poi.dvo.ru
Dovzhenko N.V., Slobodskova V.V., Matrosova I.V., Kolosova L.F., Kukla S.P., Pryazhevskaya T.S., Masur A.A.
Аннотация: В эстуарных зонах рек Раздольная и Партизанская и морских лагунах Тихая и Лебяжья (залив Петра Великого, Японское море) провели экотоксикологическую оценку состояния промыслового моллюска корбикулы японской Corbicula japonica (Prima 1864). В тканях пищеварительной железы и жабр моллюсков определяли уровень малонового диальдегида (МДА) и степень повреждения молекулы ДНК, а также микроэлементный состав тканей. Концентрация микроэлементов, а также уровень МДА в тканях моллюсков из р. Партизанская были выше, по сравнению с другими районами исследований. Высокое содержание железа обнаружено в тканях моллюсков лагуны Лебяжья, меди – из р. Раздольная. Наиболее высокие значения индекса генетического повреждения в тканях отмечены для моллюсков эстуария р. Раздольная, включая лагуну Тихую и кутовой части лагуны Лебяжьей. Установлено, что во всех исследованных нами скоплениях корбикулы японской, в тканях моллюсков наблюдается хронический окислительный стресс, имеющий различное происхождение. Молекулярные маркеры четко отразили состояние корбикулы японской из разных мест промыслового скопления в заливе Петра Великого, указывая, что в более угнетенном состоянии находятся моллюски эстуария р. Раздольная.
Summary: An ecotoxicological assessment of the state of the commercial mollusc Corbicula japonica (Prime, 1864) was carried out in the estuaries of the Razdolnaya and Partizanskaya rivers and the sea lagoons Tikhaya and Lebyazhya (Peter the Great Bay, the Sea of Japan). Markers of oxidative damage (the level of malondialdehyde and the degree of damage to the DNA molecule) were determined in the digestive gland and gills of molluscs. The microelement composition of the tissues was also determined. The concentration of trace metals and the level of malondialdehyde in the tissues of molluscs from the river Partisanskaya were higher compared to other research areas. A high iron concentration was found in the tissues of the molluscs of the lagoon Lebyazhya, copper — from the river Razdolnaya. The highest values of the index of genetic damage in tissues were noted for molluscs of the estuary of the river Razdolnaya, lagoon Tikhaya and the apex part of the lagoon Lebyazhya. In all the clusters of C. japonica studied by us, chronic oxidative stress observed, which has a different origin. Molecular markers reflected the state of the C. japonica from different places of fishing in the Peter the Great Bay, indicating that molluscs of the estuary of the river are in a more depressed river Razdolnaya.
Ключевые слова: эстуарии, мониторинг, Corbicula japonica, биомаркеры, окислительный стресс, повреждение ДНК, перекисное окисление липидов, микроэлементы.
Kay words: estuaries, monitoring, Corbicula japonica, biomonitoring, oxidative stress, lipid peroxidation, damage of DNA, microelements.
ВВЕДЕНИЕ
На сегодняшний день наиболее актуальной проблемой становится экологическая безопасность прибрежных акваторий. В зоне риска, наиболее подверженных антропогенному влиянию, оказались эстуарии и лагуны — пограничные зоны смешения морских и речных вод, характеризующиеся как специфические и, в тоже время, уникальные по своим свойствам экосистемы. По оценкам экспертов, в этих районах задерживается до 95 % взвешенных и до 40% растворенных веществ, в том числе и загрязнений речного стока. В основном это элементы, которые можно отнести как к жизненно необходимым для функционирования организма (Fe, Zn, Cu, Mn), так и к тяжелым металлам (Cd, Pb). Кроме того, наряду с тяжелыми металлами, вызывающими в организме токсичный эффект, высокие концентрации жизненно-важных микроэлементов (Fe, Cu, Zn) оказывают негативное влияние на организм [1]. Как известно, процесс аккумуляции металлов гидробионтами на прямую зависит от исходного уровня содержания в органах и резком изменении концентрации металлов в среде [2]. Поэтому контроль поступления загрязняющих веществ в биотопы и последующее влияние токсикантов на качество среды и состояние ее обитателей определило тенденцию к развитию изучения и описания самых ранних – «сигнальных» изменений в метаболизме гидробионтов [3; 4]. Такие изменения характеризуют молекулярные биомаркеры, которые количественно измеряются в клетках, тканях, биологических жидкостях на клеточном и биохимическом уровнях и свидетельствуют о присутствии загрязняющих веществ и степени ответной реакции организма [3]. В связи с чем, одним из решений проблемы изучения и прогнозирования последствий загрязняющих веществ на водных обитателей, служит определение «сигнальных» маркеров. Подобные маркеры свидетельствуют о снижении функций организма на молекулярном, клеточном и физиологическом уровнях организации, вызванных различными нарушениями. К таким показателям относят кислородные метаболиты перекисной деструкции липидов в клетке и повреждение молекулы ДНК. В биомониторинге использование биомаркеров состояния организма связывают больше с диагностикой и прогнозированием загрязнения окружающей среды, предполагая, что по изменению комплекса биохимических показателей в организме в определенном биотопе можно спрогнозировать изменение состояния на индивидуальном уровне и биоты в целом
Эстуарии и их обитатели особенно подвержены внешним воздействиям, в том числе и антропогенным. Известно, что эстуарии залива Петра Великого являются местами массовых скоплений промыслового моллюска Corbicula japonica (Prime, 1864) — ценного промыслового объекта и сырьемя для лекарственных препаратов. В связи с его многочисленностью и широким распространением, данный вид был выбран нами в качестве вида-индикатора для комплексной оценки экологического состояния эстуарных зон залива Петра Великого.
Целью данной работы стало провести экотоксикологическую оценку лагун и эстуариев рек залива Петра Великого с помощью маркеров окислительного стресса и определения микроэлементного состава тканей корбикулы японской.
МАТЕРИАЛ И МЕТОДИКИ
Моллюсков отбирали в октябре 2018 г. в эстуарных зонах рек Раздольная (станция 1), Партизанская (ст. 3), в лагунах Тихая (ст. 2) и Лебяжья (Амурский залив) (рис.1). В лагуне Лебяжья корбикулу отбирали на двух станциях – в куту (ст. 4) и в горле лагуны (ст. 5) (рис. 1).
Методики определения биомаркеров.
Выловленных моллюсков перевозили в контейнерах с принудительной аэрацией, затем препарировали на льду извлекая жабры и пищеварительную железу. Ткани немедленно замораживались при 80°С. Для определения содержания малонового диальдегида (МДА), жабры и пищеварительную железу гомогенизировали в 0,05 М фосфатном буфере pH 7.4.
Количественное содержание МДА определяли по цветной реакции с 2-тиобарбитуровой кислотой (ТБК) [5]. Определенные объемы гомогената фиксируют 30% ТХУ (трихлоруксусной кислотой) и после интенсивного перемешивания 0.75% ТБК (тиобарбитуровая кислота). Термостатирование проб производится на водяной бане при температуре 95°С на протяжении 20 минут. После термостатирования, пробы охлаждаются для быстрого завершения реакции и центрифугируются 30 минут при 3000 оборотах. Оптическая плотность полученных растворов измеряется при длине волн 532 / 580 нм на на двухлучевом спектрофотометре Shimadzu UV-2550. При расчете содержания МДА использовали коэффициент молярной экстинции (Е1М=1.56×105). Концентрация малонового диальдегида выражаем в нмоль / г сырого веса.
Для определения индекса генетического повреждения (ИГП) молекулы ДНК клеток жабр и пищеварительной железы корбикулы японской, использовали щелочной вариант кометного анализа (Singh et al., 1988), адаптированного к морским организмам [6; 7]. Регистрацию ДНК-комет проводили при сканирующем флуоресцентном микроскопе (Zeiss, AxioImager A1), с цифровой фотокамерой AxioCam MRc. Для обработки полученных цифровых изображений ДНК-комет использовали компьютерную программу Comet Score Freeware v1.5, при этом для каждой кометы вычисляли долю ДНК в хвосте кометы (% ДНК в хвосте). Также высчитывали индекс генетического повреждения (ИГП) по формуле:
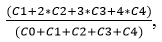
где ИГП суммируется из разных типов комет, которые делят на 5 классов С0, С1, С2, С3, С4 в зависимости от степени фрагментации ДНК (% ДНК в хвосте) [7].
Статистическую обработку полученных данных проводили с использованием программ STATISTICA 6.0 и Microsoft Exel 2013. Оценку результатов проводили методом сравнения среднегрупповых показателей (Р<0,05 с использованием непараметрического критерия Даннета) и использовали непараметрический критерий Краскелла –Уоллиса.
Количественный анализ содержания микроэлементов в мягких тканях C. japonica проводили с помощью атомно-абсорбционного метода [8; 9].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Состояние эстуарных зон залива Петра Великого напрямую зависит от экологического состояния рек, к которым эти зоны примыкают. По оценкам экспертов река Раздольная считается экологически неблагополучной, испытывая от хозяйственной деятельности человека комплексное загрязнение органическими и неорганическими соединениями, среди которых доминируют неорганический фосфор, нитраты, растворенные в воде металлы (Fe, Cu, Mn, Zn, Ni и др.) [10]. Эстуарий р. Раздольная относится к олигогалинному типу, с низким содержанием кислорода в воде. В период летних паводков с речным стоком выносится колоссальный объем биогенных веществ, с последующей эвтрофикацией и гипоксийных явлений [10]. Лагуна Тихая примыкает к Тавричанскому лиману – эстуарной зоне р. Раздольная, поэтому гидрохимические параметры схожи с характеристиками устьевой зоны и выносимыми речными водами р. Раздольная. В отличии от р. Раздольная, объемы выносимых вод р. Партизанская в два раза меньше, однако ее сток обеспечивает пресной водой восточную часть залива Петра Великого [11]. Эстуарная зона р. Партизанская характеризуется как эстуарий руслового типа с хорошим водообменом, высоким содержанием кислорода и соленостью до 34 ‰ [12]. По экспертным оценкам экологическое состояние р. Партизанская на разных участках русла оценивается от слабой загрязненного к сильно загрязненному [13]. Основными источниками загрязнения реки, в основном это высокие концентрации железа, свинца, кадмия, марганца и др., являются золоотвалы Партизанской ТЭЦ и шахтные воды ликвидированных угледобывающих шахт. Авария на Партизанской ГРЭС в 2004 г ухудшила экологическую обстановку на р. Партизанская. В результате аварии был произведен аварийный сброс золы и в реку поступило более 80 тыс. т золовой пульпы [13]. До сих пор золоотвалы на ГРЭС остаются перегруженными, в связи с чем проблема аварийных сбросов золы остается открытой. В составе золы доминируют такие элементы как алюминий, железо, свинец, кадмий и др. [14]. Помимо золы в бассейн реки поступают шахтные воды угледобывающих шахт, свободно изливающиеся на поверхность. В составе шахтных вод, поступающих в речки и ручьи Партизанского бассейна, отмечено повышенное содержание железа, марганца и цинка, общий объем которых составляет 304 м3/ч. В зоне смешения речных и шахтных вод наблюдается изменение химического состава поверхностных вод, в результате чего происходит выпадение в осадок железа, марганца и др. микроэлементов, которые концентрируются в придонном слое воды и грунтах и в гидробионтах [15].
Еще одним уникальным эстуарием является солоноватая мелководная лагуна Лебяжья. Особенность этого водоема заключается в том, что она разделена на две части – кут и горло [16]. Водообмен кутовой части лагуны с горлом лагуны очень слабый, так как они отделены друг от друга земляной дамбой с небольшим узким водотоком длиной 10 м. Соленость воды в кутовой части лагуны, не превышает 2 ‰, так как в эту часть впадают речки и ручьи. В горле лагуны, которая так же, как и кут разделено насыпью на две части, соленость составляет – 10 – 12 ‰, у входа в лагуну – 30-33 ‰ [16]. Особенные условия, созданные природой и антропогенной нагрузкой на исследованные эстуарные зоны, отразились на состоянии моллюсков.
Сравнительный анализ микроэлементного состава тканей корбикулы японской показал высокое содержание всех исследованных нами элементов в жабрах и пищеварительной железе корбикулы из р. Партизанская (ст. 3), значения которых превышали концентрации элементов у моллюсков из других эстуариев (табл. 1, 2).

Отмечены высокие концентрации железа, свинца и кадмия в пищеварительной железе корбикулы со ст. 3 (993,34±41,0 мкг/ г сух. массы, 13,22±0,55 мкг/ г сух. массы 1,641±0,08 мкг/ г сух. массы соответственно), содержание которых превышают значения из других районов исследования. Отмечено высокое содержание Fe в пищеварительной железе корбикул со станций 4 и 5 (621,8±29,1 мкг/ г сух. массы и 514,9±18,03 мкг/ г сух. массы соответственно). В жабрах и пищеварительной железе корбикул со станций 1 и 2 получены высокие концентрации Mn (8,15±0,039 мкг/ г сух. массы и 8,17±0,05 мкг/ г сух. массы соответственно) по сравнению с другими станциями. В пищеварительной железе моллюсков станций 1, 4, 5 были отмечены самые высокие концентрации меди (табл. 2).
По данным, полученным в 2010 г., в жабрах корбикулы из. р. Раздольная концентрация Fe составляла от 1333 — 2324 мкг/г сух. веса [17], которые можно считать, как высокие значения. Полученные нами результаты дают нам основание полагать, что корбикула в р. Партизанская испытывает загрязнение, обусловленное повышенным содержанием железа и свинца в воде и донных осадках. Концентрации этих металлов в пищеварительной железе и жабрах превышало в 2 – 2,5 раза содержание этих элементов у моллюсков из других исследованных эстуарных зон. Полученные результаты по содержанию МДА указывали на развитие деструктивных окислительных процессов в тканях моллюсков. По степени выраженности окислительного стресса в тканях корбикулы японской, исследованные эстуарии были расположены по убыванию концентрации МДА в тканях: относительно пищеварительной железы — лагуна Лебяжья (1) > р. Партизанская > лагуна Лебяжья (2) > р. Раздольная > лагуна Тихая; относительно жабр — лагуна Лебяжья (1) > лагуна Тихая> р. Партизанская > р. Раздольная > лагуна Лебяжья (2) (табл. 3).

Накопление МДА в клетках жабр и пищеварительной железы моллюсков имело видимую дифференциацию по тканям, что связано с функциями органов – уровень МДА в пищеварительной железе выше, чем в жабрах. Наиболее высокие значения МДА отмечены в клетках пищеварительной железы ст. 4 и ст. 3 (9,179±04 нмоль/г сыр.веса и 9,95±0,45 нмоль/г сыр.веса соответственно). В жабрах высокие концентрации МДА отмечены для моллюсков со станций 2 и 4 (4,67±0,23 нмоль/г сыр. веса 4,47±0,29 нмоль/г сыр. веса соответственно). Высокие значения уровня МДА в тканях, особенно в клетках пищеварительной, свидетельствуют о развитии окислительного стресса, в некоторых случаях уже хронического.
При характеристике хронического воздействия стрессовых факторов на гидробионтов, наиболее информативными можно считать результаты, полученные для органов, участвующих аккумуляции, детоксикации и транспорта токсичных веществ, в нашем случае – для пищеварительной железы. Анализируя результаты, мы полагаем, что высокий уровень МДА в пищеварительной железе моллюсков из р. Партизанская и кутовой части лагуны Лебяжья связан с высоким содержанием железа. Как известно, железо является реакционноспособным элементом, являясь потенциально токсичным, и, при его активной аккумуляции в клетках «хранение» контролируется транспортными и связывающими белками [18]. Кроме того, в клетках также присутствует комплекс лабильного пула железа и различных низкомолекулярных лигандов, составляющий минорную часть от общего содержания железа в клетке [19]. В свою очередь избыток Fe (как элемента с переменной валентностью) приводит к развитию окислительного стресса путем реакции Хабера-Вейса — железо-зависимого превращения супероксидного радикала кислорода и перекиси водорода в токсичный гидроксильный радикал [20]. Ранее, на моллюсках Mya arenaria и Laternula elliptica было показано, что чем выше содержание лабильного железа в тканях, тем выше содержание МДА [18].
Кроме того, результаты, полученные для моллюсков из кутовой части лагуны Лебяжья, дают основание полагать, что развитие окислительного стресса в этой акватории усугубляют гипоксийные явления и низкое значение pH в придонном слое водоема (5,6) при оптимуме водородного показателя для гидробионтов 8.0 [21]. Об этих воздействиях можно судить по высокому содержанию МДА в клетках жабр моллюсков ст. 4, так как жабры – это орган моментального реагирования на дефицит кислорода и изменение pH. Снижение pH водной среды приводит к необратимым физиологическим и биохимическим процессам в организме, выраженным в деформации и декальценировании раковины, к увеличению уровня оксирадикалов в клетках, повреждении молекулы ДНК. В работе Явнова и Ракова также упоминалось о заморных явления, наблюдаемых в районе дамбы лагуны [16].
По сравнению со ст. 3 и 4, содержание МДА в клетках пищеварительной железы корбикулы со ст. 1 и 2 был ниже, однако стоит отметить, что в жабрах содержание МДА были на одном уровне с моллюсками из этих районов. Скорее всего у моллюсков из этих эстуариев механизм окислительного стресса «запущен» гипоксийными явлениями, которые часто наблюдаются в данных районах, и большее их воздействие отразилось на жабрах.
МДА является индикатором острого воздействия оксирадикалов в клетках. Последующие действия МДА обусловлены его структурой, в наличии которой находится две альдегидные группы, которые могут взаимодействовать с аминогруппами белков, в связи с чем МДА проявляет цито- и генотоксическое действие [22].
В результате исследований были показано генотоксическое воздействие среды на моллюсков из разных акваторий залива Петра Великого. В пищеварительной железе наиболее высокие значения ИГП были получены для моллюсков р. Раздольная (0,52) и морских лагун ст. 2 и 4 (0,47 и 0,426 соответственно), тогда как степень повреждения ДНК в клетках пищеварительной железы и жабр р. Партизанская была самая низкая по сравнению с другими районами исследований (0,25 и 0,181 соответственно) (табл. 3).
Если рассматривать состояние моллюсков эстуарной зоны р. Партизанская и лагуны Лебяжья, где наблюдается высокая концентрация железа в тканях, и, как следствие высокое содержание МДА, но низкий уровень ИГП, то можно говорить о длительной комплексной стимуляции биохимических систем защиты корбикулы японской, результатом которой стала эффективная адаптация антиоксидантной системы, стабилизация содержания конечных продуктов ПОЛ и снижение уровня повреждения ДНК. Подобные результаты были получены для двустворчатого моллюска Crenomytilus grayanus из б. Десантная (залив Петра Великого, Японское море), где несколько десятилетий наблюдалось хроническое загрязнение грунтов и вод, прежде всего, тяжелыми металлами. В тех условиях была отмечена эффективная адаптация антиоксидантной системы моллюсков при постоянном многолетнем поступлении загрязнителей в акваторию бухты [23; 6].
Заключение
Установлено, что во всех исследованных нами скоплениях корбикулы японской, в тканях моллюсков наблюдается хронический окислительный стресс, имеющий различное происхождение. Молекулярные маркеры четко отразили состояние корбикулы японской из разных мест промыслового скопления в заливе Петра Великого, указывая, что в более угнетенном состоянии находятся моллюски эстуария р. Раздольная.
Полученные результаты по микроэлементному составу доказывают загрязнение эстуариев, при этом дифференцируя их на зоны с различным характером загрязнения.
СПИСОК ЛИТЕРАТУРЫ
- Шулькин В.М. 2004. Металлы в экосистемах морских мелководий. Владивосток: Дальнаука, 279 с.
- Кавун В. Я., Шулькин В. М. 2005. Изменение микроэлементного состава органов и тканей двустворчатого моллюска Crenomytilus grayanus при акклиматизации в биотопе, хронически загрязненном тяжелыми металлами // Биология моря. Т 31. № 2. С. 123-128
- Лукьянова О.Н. 2001. Молекулярные биомаркеры. — Владивосток: Издательство ДВГАЭУ. 196 с.
- Лукьянова О.Н. Корчагин В.П. 2017. Интегральный биохимический индекс состояния водных организмов в условиях загрязнения // Известия РАН. Серия Биологическая. №2. С. 174-180.
- Buege J. A., Aust S. D. 1978. Microsomal lipid peroxidation. Methods in Enzymology, ed. by S. Fleischer, L. Packer. New York: Academic Press. P. 302–310.
- Кукла С.П. Слободскова В.В., Челомин В.П. 2017. Генотоксические свойства оксидов меди в наноформе для морских организмов на примере тихоокеанской мидии Mytilus trossulus Gould, 1850 (Bivalvia: Mytilidae) // Биология моря. Т. 43. № 2. С. 139– 143.
- Slobodskova V.V., Zhuravel E.V., Kukla S.P., Chelomin V.P. 2019. Evaluation of DNA damage in the marine mussel Crenomytilus grayanus as a genotoxic biomarker of pollution // Journal of Ocean University of China. № 18, V. 1. P. 159–164.
- Julshamn K., Andersen K.-J. 1983. Subcellular distribution of major and minor elements in unexposed molluscs in western norway-I. The distribution and binding of cadmium, zinc and copper in the liver and the digestive system of the oyster Ostrea edulis // Comp. Biochem. Physiol. V. 75A. P. 9–12.
- Никаноров А.М., Жулидов А.В., Покаржевский А.Д. 1985. Биомониторинг тяжелых металлов в пресных экосистемах. Ленинград: Гидрометеоиздат. 144 c.
- Тищенко П.Я., Семкин П.Ю., Тищенко П.П., Звалинский В.И., БарабанщиковЮ.А., Михайлик Т.А., Сагалаев С.Г., Швецова М.Г., Шкирникова Е.М., Шулькин В.М. 2017. Гипоксия придонных вод эстуария реки Раздольная. Доклады Академии наук. — Т.467, № 5. С. 576-580
- Shulkin V., Tishchenko P., Semkin P., Shvetsova M. 2018. Influence of river discharge and phytoplankton on the distribution of nutrients and trace metals in Pazdolnaya River estuary, Russia // Estuarine, Coastal and Shelf Science. № 211. P. 166-176)
- Семкин П.Ю., Тищенко П.Я., Лобанов В.Б., Барабанщиков Ю.А., Михайлик Т.А., Сагалаев С.Г., Тищенко П.П. 2019. Обмен вод в эстуарии реки Раздольной (Амурский залив, Японское море) в период ледостава // Известия ТИНРО. Т. 196. С. 123–137.
- Павлова Г.Ю., Тищенко П.Я. 2014. Гидрохимический режим эстуария р. Раздольной (Амурский залив, Японское море) // Вода: химия и экология. №12. С. 16–25.
- Адеева Л.Н. и Борбат В.Ф. 2014. Зола ТЭЦ – перспективное сырье для промышленности // Вестник Омского университета. № 2. С. 141-151.
- Тарасенко И.А. 2010. О состоянии окружающей природной среды в районах ликвидированных угольных шахт (на примере Партизанского района Приморского края) // Вестник ДВО РАН. № 3. С. 113-118.
- Явнов С.В., Раков В.А. 2002. Корбикула. – Владивосток: ТИНРО-центр, 145 с.
- Калинина Г.Г. 2010. Содержание некоторых металлов в мягких тканях двустворчатого моллюска корбикулы японской Corbicula japonica // Научные труды Дальрыбвтуза. № 22. С. 20-23.
- Gonzalez P.M., Wilhelms-Dick D., Abele D. and Puntarulo S. 2012. Iron in coastal marine ecosystems: role in oxidative stress/ Oxidative stress in aquatic ecosystems, 1st Edition. Eds.: D. Abele, J.P. Vázquez-Medina and T. Zenteno-Savín. Blackwell Publishhing Ltd. Chapter 8. P. 115–125.
- Kruszewski M. 2004. The role of labile irone in cardiovascular diseases // Acta Biochimica Polonica. 51 (2), P. 471–480.
- Halliwell B. and Gutteridge J.M.C. 2007. Free radicals in biology and medicine. 4th edition. Oxford University Press, Oxford. 851 p
- Слободскова В.В. 2012. Оценка воздействия неблагоприятных факторов среды на морских двустворчатых моллюсков с помощью метода ДНК-комет: дис. … канд. биол. наук. Дальневост. федерал. университет, Владивосток.
- Болдырев А.А. 2001. Окислительный стресс и мозг // Соросовский Образ. Журн. — Т. 7. № 4. С. 21-28.
- Довженко Н.В., Бельчева Н.Н., Челомин В.П. 2014. Реакция антиоксидантной системы мидии Грея Crenomytilus grayanus как индикатор загрязнения прибрежных акваторий (залив Петра Великого в Японском море) // Вестник МГОУ. Серия «Естественные науки». № 4. С. 57– 66.


